 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Związki heterocykliczne
Związki heterocykliczne
Zazwyczaj w chemii organicznej za związek hetorocykliczny uważa się każdy związek cykliczny, który zawiera w części cyklicznej inny pierwiastek niż węgiel. Jednakże istnieje kilka wyjątków od tej reguły: niektóre klasy związków organicznych, takie jak węglowodany, zazwyczaj nie są nazywane związkami heterocyklicznymi, mimo że z formalnego punktu widzenia nimi są. Ponadto wiele związków makrocyklicznych zwyczajowo nie jest nazywanych związkami heterocyklicznymi. W przypadku wielu związków chemicznych, które są "standardowo" zbudowane z regularnie występujących dwóch rodzajów atomów (np. tlenu i węgla (eter koronowy) lub z krzemu i tlenu (cyklosiloksany), lub azotu i fosforu (fosfazen) terminu "związek heterocykliczny" używa się dopiero wtedy, gdy w cyklu pojawiają się jeszcze jakieś inne atomy, np. azotu lub w przypadku cyklosiloksanów i fosfazenów – paradoksalnie – węgla.
Treści tej strony poświęcona jest pewnym zagadnieniom dotyczącym aromatycznych związków heterocyklicznych. Pojęcie aromatyczności reprezentowane przez benzen jest znane i stosunkowo proste. Różnica między benzenem z jednej strony a alkenami z drugiej jest dobrze znana: te ostatnie reagują z elektrofilami, np. brom, łatwo przez addycję, podczas gdy benzen reaguje tylko w znacznie ostrzejszych warunkach, i to głównie przez podstawienie. Różnica wynika z cyklicznego ułożenia sześciu elektronów π w benzenie, które tworzą o układ sprzężony, który jest termodynamicznie znacznie bardziej stabilny niż odpowiadający mu układ niecyklicznie sprzężony. Dodatkowa stabilizacja skutkuje zmniejszoną tendencją do reakcji przez addycję i większą tendencją do reakcji przez podstawienie, co zapewnia zachowanie cyklicznego sprzężonego układu elektronów w produkcie reakcji. Ogólna zasada zaproponowana przez Hückela w 1931 r. mówi, że aromatyczność obserwuje się w cyklicznie sprzężonych układach 4n + 2 elektronów, czyli z 2, 6, 10, 14 itd., elektronami π. Zdecydowanie większość monocyklicznych układów aromatycznych i heteroaromatycznych to układy z sześcioma elektronami π.
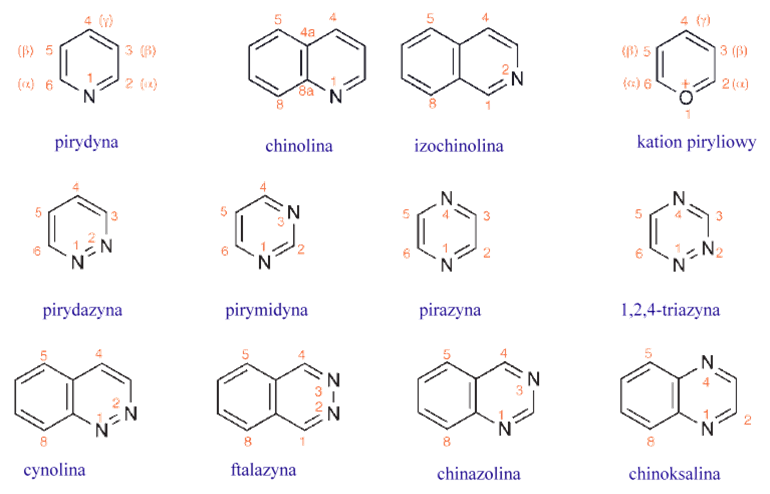 Sześcioczłonowe aromatyczne związki heterocykliczne
Sześcioczłonowe aromatyczne związki heterocykliczne
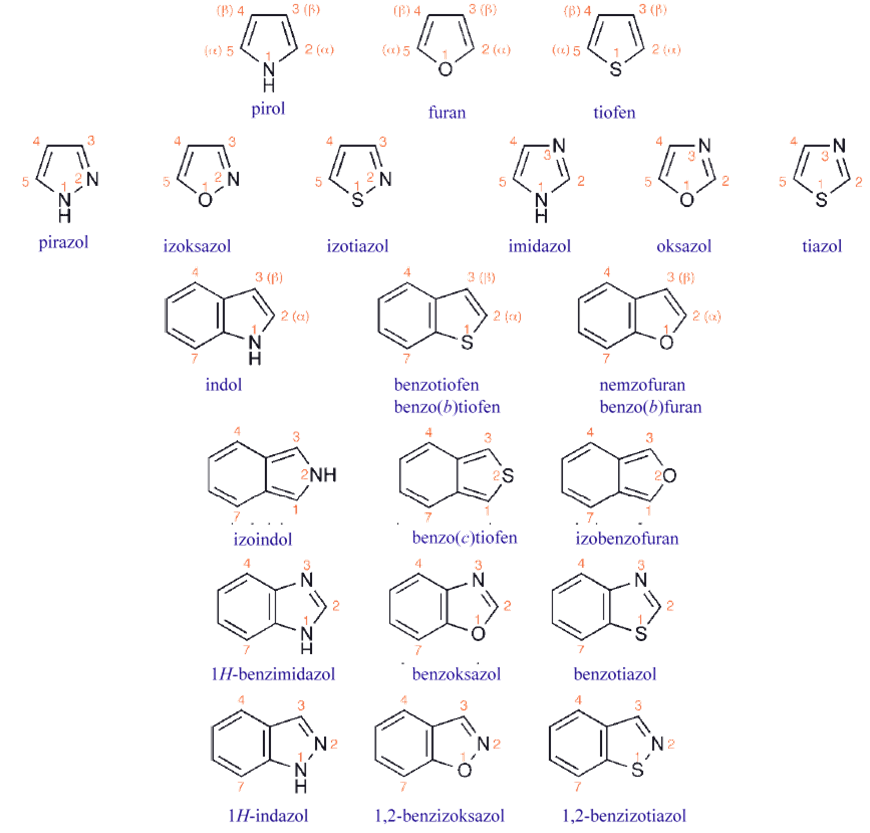 Pięcioczłonowe aromatyczne związki heterocykliczne
Pięcioczłonowe aromatyczne związki heterocykliczne
Struktury elektronowe sześcioczłonowych układów heterocyklicznych
Struktura pirydyny jest analogiczna do struktury benzenu, w którym zastąpiono CH atomem azotu. Kluczowymi różnicami są:
- odejście od idealnie regularnej geometrii heksagonalnej spowodowane obecnością heteroatomu, w szczególności krótszymi wiązaniami węgiel – azot,
- zastąpienie wodoru w płaszczyźnie pierścienia niedzieloną parą elektronową, zajmującą zhybrydyzowany orbital sp2, nie uczestniczącą w aromatycznym sekstecie elektronów π; jest to wolna para elektronowa azotu, odpowiedzialna za podstawowe właściwości pirydyn
- wykazywanie silnego momentu dipolowego, związanego z większą elektroujemnością azotu w porównaniu z węglem.

Należy zdać sobie sprawę, że elektroujemny azot powoduje poprzez indukcję polaryzację głównie w ramach wiązania σ, a dodatkowo stabilizuje te spolaryzowane wkłady mezomeryczne, w których azot jest obdarzony ładunkiem ujemnym. Spolaryzowane wkłady implikują również trwałą polaryzację układu elektronów π.

Polaryzacja wynikająca z efektów indukcyjnych i mezomerycznych jest w pirydynie zgodna co do orientacji, co skutkuje trwałym momentem dipolowym w kierunku atomu azotu. Oznacza to również, że na węglach w pierścieniu znajdują się ułamkowe ładunki dodatnie, zlokalizowane głównie w pozycjach α i γ. Z powodu tego niedoboru elektronów na atomach węgla pirydyna i podobne heterocykle są określane jako obdarzone „deficytem elektronowym” lub przejawiającymi deficyt π. Porównanie z momentem dipolowym piperydyny, który w całości wynika z indukowanej polaryzacji elektronów σ, daje wyobrażenie o dodatkowej polaryzacji związanej z odkształceniem układu π-elektronowego. Moment dipolowy pirydyny to 2,21 D, a piperydyny 1,17 D.
Struktury elektronowe diazyn są analogiczne chociaż tutaj mamy dwa atomu azotu w pierścieniu.

Pięcioczłonowe układy heteroaromatyczne
Przed omówieniem pirolu należy przyjrzeć się strukturze anionu cyklopentadienylowego, który jest sześcioelektronowym układem aromatycznym, wytworzonym przez usunięcie protonu z cyklopentadienu. Ten system ilustruje różnicę między stabilizacją aromatyczną a reaktywnością, ponieważ jest to bardzo reaktywna, całkowicie ujemnie naładowana jednostka, a mimo to jest „stabilizowana rezonansowo”. Cyklopentadien, z pKa około 14, jest znacznie bardziej kwasowy niż prosty dien, tylko dlatego, że powstały anion jest stabilizowany rezonansowo. Pięć równoważnych struktur , pokazuje, że każdy atom węgla jest równoważny, a zatem niesie jedną piątą ładunku ujemnego.

Pirol jest izoelektronowy z anionem cyklopentadienylowym, ale jest elektrycznie obojętny ze względu na wyższy ładunek jądrowy na azocie. Inną konsekwencją obecności azotu w pierścieniu jest utrata symetrii radialnej, tak że pirol nie ma pięciu równoważnych form mezomerycznych: ma jedną bez rozdzielenia ładunku, oraz dwie pary form równoważnych, w których występuje separacja ładunku, wskazująca na przesunięcie gęstości elektronowej od azotu.

Rezonans prowadzi zatem do utrwalenia częściowych ładunków ujemnych na węglu i częściowego ładunku dodatniego na azocie. Wpływ indukcyjny azotu jest skierowany do heteroatomu, tak że rozkład elektronowy w pirolu jest równowagą dwóch przeciwstawnych efektów, z których efekt mezomeryczny jest prawdopodobnie bardziej znaczący, co powoduje, że kierunek momentu dipolowego jest od azotu do węgli. Przeniesienie elektronów od azotu w kierunku węgli powoduje, że pięcioczłonowe heterocykle typu pirolu określane są jako „bogate w elektrony”.

Struktury tiofenu i furanu są bardzo podobne do pirolu, z wyjątkiem tego, że NH zostaje zastąpione odpowiednio przez S i O. Konsekwencją jest to, że heteroatom w każdym z nich ma jedną wolną parę elektronową stanowiącą część sekstetu aromatycznego, jak w pirolu, ale ma również drugą parę elektronową, która nie jest zaangażowana w układ aromatyczny i znajduje się na hybrydowym orbitalu sp2 w płaszczyźnie pierścienia . Formy mezomeryczne analogiczne do pirolu można zapisać dla każdego z nich, ale wyższa elektroujemność zarówno siarki, jak i tlenu oznacza, że spolaryzowane formy, z dodatnimi ładunkami na heteroatomach, mają mniejszy udział. Zmniejszony przepływ elektronów mezomerycznych od heteroatomów jest w tych dwóch przypadkach niewystarczający, aby przezwyciężyć polaryzację indukcyjną w kierunku heteroatomu (momenty dipolowe tetrahydrotiofenu i tetrahydrofuranu, odpowiednio 1,87 D i 1,68 D, w kierunku heteroatomu, są w każdy przypadku większe niż w przypadku pirolidyny), a efektem jest to, że dipole są skierowane w stronę heteroatomów w tiofenu i furanie.
1,3- i 1,2-azole, pięcioczłonowe pierścienie z dwoma heteroatomami, stanowią kombinację typów heteroatomów – we wszystkich przypadkach jeden heteroatom musi należeć do pięcioczłonowego heterocyklu (pirol, tiofen, furan ) typu i jednego typu iminy, jak w pirydynie. Najlepiej ilustruje to imidazol z dwoma atomami azotu.
