 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Wczesne etapy badania procesu spalania i natury powietrza
Wczesne etapy badania procesu spalania i natury powietrza
Na poprzednich stronach prześledziliśmy rozwój chemii od najwcześniejszego okresu do czasu, kiedy zaczęła kształtować się jako odrębna nauka. Mówi się, że cel chemii „zmienia się od czasu do czasu. Kiedyś chemia mogła być nazwana teorią życia, a innym razem działem metalurgii; kiedyś zajmowała się badaniem procesu spalania, a innym razem poszukiwaniem lekarstw; kiedyś była próbą zdefiniowania pojedynczego słowa – element, a innym razem dążeniem do niezmiennej podstawy wszystkich zjawisk. Chemia wydawała się czasem rękodziełem, czasem filozofią, czasem tajemnicą, a czasem nauką.”
Spalanie i kalcynacja metali
Istnieją dwa rodzaje przemian chemicznych, które, ponieważ były badane jednocześnie, i są wywoływane tą samą przyczyną, dogodnie jest opisać je razem. Są to spalanie i kalcynacja metali.
Alchemicy przywiązywali wielką wagę do wpływu ciepła na substancje, a w ich pismach znajduje się wiele opisów rodzajów pieców i przeprowadzanych z nimi eksperymentów. Stwierdzono, że metale, z wyjątkiem złota i srebra, zmieniają się po podgrzaniu w otwartych tyglach pozostawiając żużel, który został nazwany wapnem (łacińskie calx, wapno). W szesnastym wieku zauważono, że ta pozostałość jest cięższa od metalu, co zwykle tłumaczono ucieczką jakiejś „duszy” z metalu lub tym, że materia stała się gęstsza lub, że jakiś kwas pochodzący z ognia został zaadsorbowany przez metal, który to kwas miał posiadać ciężar, a pochłonięty przez metal przy tworzeniu wapna zwiększał jego masę. Dalsze badania spalania i kalcynacji podjęli R. Boyle, R. Hooke i J. Mayow, którzy zostali nazwani „chemikami Oxfordu”, ponieważ wszyscy pracowali przez pewien czas w Oksfordzie, a R. Hooke i J. Mayow byli absolwentami tego uniwersytetu.
Większość informacji o życiu Roberta Boyle’a pochodzi z autobiografii oraz pism zebranych przez Thomasa Bircha w „Collected Works of the Honourable Robert Boyle” opublikowanych w roku 1744. Z dokumentów rysuje się obraz człowieka, który uważał się za narzędzie Boskiego planu poprawy człowieczeństwa, którego rezultatem ma być dobroczynność i zastosowanie filozofii Bacona, czyli poprawa kondycji ludzkiej poprzez naukę. W okresie kiedy nauka praktycznie nie istniała, a jej prestiż był znikomy, pozycja społeczna R. Boyle'a, i atrakcyjna, uprzejma osobowość wywarły wpływ na podniesienie statusu społecznego nauki. Był jednym z założycieli i członkiem rady naukowej Królewskiego Towarzystwa Naukowego (Royal Society). W czasie pobytów w Londynie regularnie uczestniczył w spotkaniach Towarzystwa i pozostał jednym z jego najbardziej wpływowych członków. W roku 1680 został wybrany przewodniczącym Towarzystwa, ale odmówił przyjęcia stanowiska gdyż statut wymagał złożenia przysięgi, czynu na który jego sumienie nie pozwalało. R. Boyle był człowiekiem głęboko religijnym. Mówiono, że nigdy nie wymówił imienia boskiego bez chwilowej przerwy w wypowiedzi mającej podkreślić cześć jaką przykładał do tego słowa. Jak twierdzili jego przyjaciele ten sposób postępowania nie został ani razu pominięty przez 40 lat życia. Dużo czasu spędzał na modlitwach i medytacji, napisał wiele traktatów o religii i teologii, cytował fragmenty Pisma Świętego z pamięci swobodnie po angielsku i po grecku. Przez 16 lat, od 1661 do 1677 roku, był dyrektorem sławnej Kompanii Wschodnioindyjskiej. Do objęcia posady skłoniła go chęć propagowania chrześcijaństwa wśród rdzennych mieszkańców różnych rejonów świata. W ramach sprawowanej funkcji wywierał wpływ na pracowników Kompanii w celu poprawy warunków bytowych na terenach objętych ich działaniami. Z tym samym zamysłem osobiście wspierał tłumaczenia Biblii na języki turecki, arabski i malajski oraz dialekty amerykańskich Indian na terenie kolonii w Massachusetts. Około jednej trzeciej swoich dochodów przeznaczał na cele charytatywne i na rozwój nauki. Nigdy się nie ożenił, być może z powodów religijnych, ale co bardziej prawdopodobne skutkiem złego stanu zdrowia. Ostatnie 23 lata swego życia spędził w Londynie mieszkając ze starszą siostrą Katheriną, wicehrabiną Ranelagh. Pomimo swego wysokiego statusu społecznego i bogactwa żył bardzo skromnie. Był szczery, wyjątkowo uprzejmy i troskliwy wobec innych. W ramach samodyscypliny nauczył się uważnie słuchać opinii innych osób. Te cechy powodowały, że wiele osób tak z Londynu jak i zagranicy szukało z nim kontaktu, na co prywatnie narzekał, stwierdzając że wielu z nich marnuje jego czas na błahostki. W przeciwieństwie do innych uczonych publikował szczegółowe opisy swoich eksperymentów i przemyśleń, nie próbując niczego zataić dla zysku. Przytoczone szczegóły z życia Boyle'a są użyteczne dla zrozumienia jego poglądów, środowiska i wpływu na naukę.
Richard Boyle, ojciec uczonego, po ukończeniu Eton College w Cambridge, a następnie praktykach prawniczych w Londynie nie widząc dla siebie przyszłości w Anglii przeniósł się w 1588 roku do Irlandii, gdzie zgromadził pokaźną fortunę. W prowincji Munster wybudował wiejską posiadłość Lismore. W roku 1620 uzyskał tytuł szlachecki stając się pierwszym Earlem Corku. Robert urodził się w Lismore 25 stycznia 1627 roku, będąc czternastym dzieckiem i siódmym synem lorda. W dzieciństwie Robertem zajmowali się prywatni nauczyciele uczący go łaciny, greki i francuskiego. W wieku 8 lat, po śmierci matki, został wysłany do Eaton, gdzie wykazał duże zainteresowanie nauką przedkładając ją nad zabawę. Dodatkowo ojciec zatrudnił prywatnego nauczyciela, Roberta Carewa, znającego język irlandzki, aby ten dodatkowo uczył jego synów podczas pobytu w Eaton. W grudniu 1638 roku, po spędzeniu w Eaton niecałych czterech lat, Robert został wraz ze swoim bratem wysłany do Genewy w celu kontynuowania nauki. W pamiętnikach zanotował gwałtowną burzę jaka miała miejsce, a która wywarła na nim głębokie i trwałe wrażenie. Zjawisko to uznał za demonstrację boskiej mocy, która wzbudziła w nim podziw i sprawiła, że postanowił poświęcić życie działaniom promującym boskie dzieło na ziemi. Spełnienie tego postanowienia stało się możliwe w wyniku zdarzeń jakie zaszły na terenie Irlandii, i przypadkowej znajomości jaką zawarł po powrocie do kraju. W wyniku chwilowych trudności finansowych będących skutkiem buntu w Irlandii w roku 1642, jego powrót z podróży po kontynentalnej Europie nastąpił dopiero w 1644 roku. Podczas krótkiego pobytu w Londynie spotkał protestanckiego uchodźcę z Polski, Samuela Hartliba, który wskazał mu kierunek w jakim powinien podążać aby spełnić swoje postanowienie służenia boskiej sprawie. S. Hartlib był utopistą, zainteresowanym założeniem „filozoficznego” college'u, w którym eksperyment byłby metodą odkrywania natury, a użyteczna wiedza celem dociekań. R. Boyle był pod ogromnym wrażeniem tych pomysłów. W ciągu kilku miesięcy, gdy osiadł w Stalbridge, które odziedziczył po śmierci ojca, zaczął studiować anatomię, medycynę, filozofię naturalną, astronomię, chemię i fizykę wraz z teologią. Z wyjątkiem dwóch lat, jakich wymagał nadzór jego posiadłości, spędził większość następnych dziewięciu lat w swoim dworku w Dorset. Cały czas utrzymywał kontakty ze środowiskiem naukowym Londynu za pośrednictwem Hartliba, wykazując szczególne zainteresowanie chemią.
W 1654 roku po wyjeździe z Irlandii został przekonany przez Johna Wilkinsa z Wadham College, do zamieszkania w Oxfordzie. J. Wilkins był oddanym zwolennikiem nowej filozofii eksperymentalnej. Przed wyjazdem do Oksfordu był inicjatorem małej, ale wyróżniającej się grupy naukowej w Londynie. Miał niezwykły dar inspirowania przyjaźni i szacunku oraz niezwykły talent do łączenia ludzi w celu wymiany myśli i poważnych dyskusji na temat eksperymentalnych nauk przyrodniczych. W skład grupy spotykającej się regularnie w Wadham wchodzili profesorowie geometrii i astronomii John Wallis i Seth Ward, John Christian Goddard z Merton College, Ralph Bathurst późniejszy przewodniczący Trinity College, lekarz dr Thomas Willis profesor filozofii naturalnej oraz Christopher Wren członek All Souls College, architekt, który odbudował Londyn po pożarze z roku 1666. Później wszyscy oni stali się założycielami Królewskiego Towarzystwa Naukowego (Royal Society). Zaproszenie ze strony J. Wilkinsa było dla R. Boyle’a atrakcyjne, gdyż oferowało stymulującą atmosferę naukową, w której mógł kontynuować swoje studia teologiczne oraz zajmować się nauką eksperymentalną. Przekonanie nurtujące Boyle’a o niedostatecznej wiedzy jaką posiada, oraz stan jego zdrowia połączony z pragnieniem uzyskania odpowiednich warunków do prowadzenia eksperymentów spowodowały, że zamieszkał nie na terenie kampusu, a przy High Street obok uniwersytetu. Jego pobyt w Oxfordzie rozpoczął się w czerwcu 1654 roku i trwał przez 14 lat.
R. Boyle jest uważany za założyciela współczesnej chemii z trzech powodów. Po pierwsze zdał sobie sprawę, że chemia jest nauką ze względu na samą siebie, a nie tylko jako pomoc w medycynie lub jako alchemia, chociaż wierzył w możliwość tej drugiej. Po drugie wprowadził rygorystyczną metodę eksperymentalną do chemii, i po trzecie podał jasną definicję pierwiastka wykazując eksperymentalnie, że cztery pierwiastki Arystotelesa i trzy zasady alchemików (rtęć, siarka i sól) nie zasługują na miano pierwiastków lub zasad, ponieważ żadnego z alchemicznych tworów nie można wyodrębnić z ciał materialnych takich jak na przykład metale. W pewnym sensie był on antycypowany przez van Helmonta, którego dzieła Boyle studiował z uwagą, i którego często określał mianem autorytetu.
Poglądy Boyle’a na temat chemii zostały wyrażone w jego dziele: „The Sceptical Chymist: or Chymico-Physical Doubts & Paradoxes, touching the Spagyrist's Principles commonly call'd Hypostatical, as they are wont to be Propos'd and Defended by the Generality of Alchymists”, wydanej w Londynie w 1661 r. R. Boyle był dobrym eksperymentatorem i ulepszył wiele aparatów używanych w owym czasie. Przeprowadził wiele  Eksperyment O. von Guerickego z półkulami magdeburskimi (Otto von Guericke, von Guerickes Halbkugelexperiment, Physik & Vakuumtechnik & Luftdruck 1672)eksperymentów dotyczących wpływu obniżonego ciśnienia za pomocą pompy powietrza. Jego badania nad właściwościami atmosfery zostały zainspirowane przez eksperymenty Ottona von Guerickego przeprowadzone w Niemczech, opisane w książce Mechanica hydraulica-pneumatica, opublikowanej w 1657 r. przez jezuitę Gaspara Schotta, we Frankfurcie.
Eksperyment O. von Guerickego z półkulami magdeburskimi (Otto von Guericke, von Guerickes Halbkugelexperiment, Physik & Vakuumtechnik & Luftdruck 1672)eksperymentów dotyczących wpływu obniżonego ciśnienia za pomocą pompy powietrza. Jego badania nad właściwościami atmosfery zostały zainspirowane przez eksperymenty Ottona von Guerickego przeprowadzone w Niemczech, opisane w książce Mechanica hydraulica-pneumatica, opublikowanej w 1657 r. przez jezuitę Gaspara Schotta, we Frankfurcie.
W doświadczeniu, przeprowadzonym w Magdeburgu, Otton von Guericke wykorzystał dwie półkule metalowe o średnicy 42 cm każda, o starannie zeszlifowanych krawędziach. Półsfery zostały dociśnięte do siebie i uszczelnione, a następnie wypompowano ze środka powietrze. Okazało się, że do rozerwania tak powstałej kuli potrzebnych było 16 koni. Była to demonstracja istnienia ciśnienia atmosferycznego. Zafascynowany tym doświadczenie R. Boyle stwierdził, że pompa użyta do usunięcia powietrza z metalowej kuli może mieć szerokie zastosowanie w innych badaniach nad właściwościami atmosfery. W celu przeprowadzenia swoich eksperymentów potrzebował kogoś kto mógłby ulepszyć konstrukcję pompy von Guerickego. T. Willis, członek grupy J. Wilkinsa, polecił swojego asystenta, chemika Roberta Hooke’a, który przyjął ofertę i w krótkim czasie skonstruował pompę przydatną do eksperymentów zaplanowanych przez Boyle’a. To zapoczątkowało owocny związek pomiędzy dwoma badaczami trwający przez całe życie Roberta Boyle’a. Stosując pompę konstrukcji Hooke’a Boyle przeprowadzał przykładowo destylację pod zmniejszonym ciśnieniem.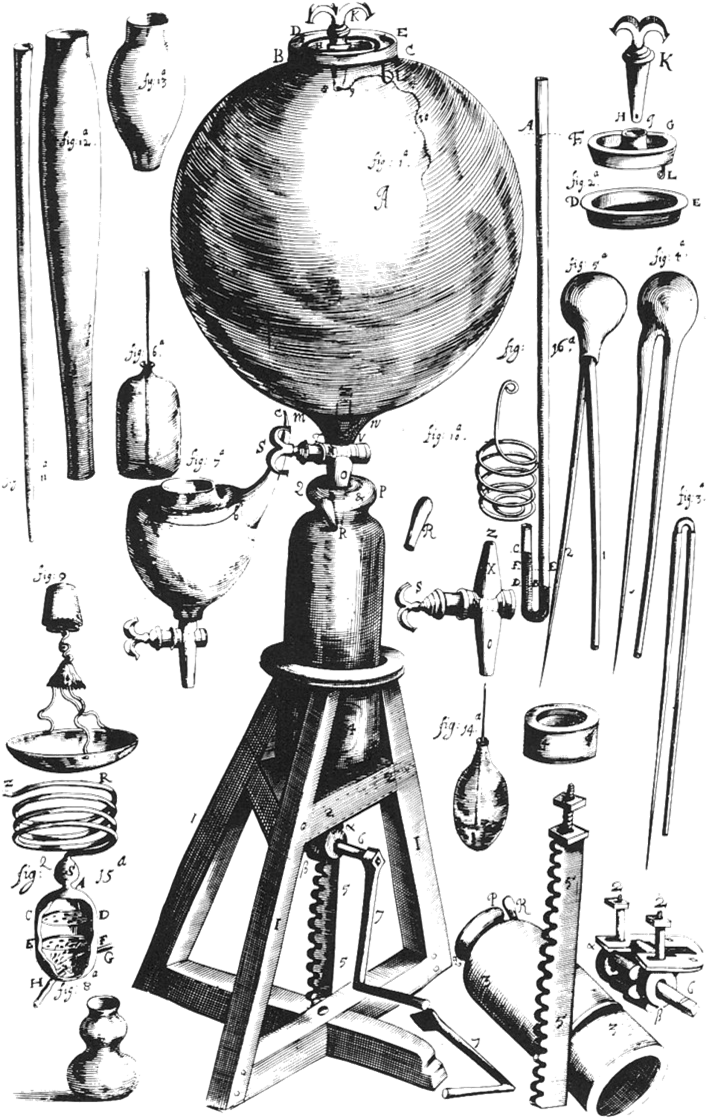 Rysunek R. Boyle’a z 1661 przedstawiający pompę powietrzną
Rysunek R. Boyle’a z 1661 przedstawiający pompę powietrzną
W Sceptical Chymist Boyle podaje, że soli, siarki i rtęci (alchemicznych elementów) nie można wyodrębnić ze złota. Pisze również, że w azotanie(V) miedzi(II) miedź jest tylko maskowana; kwas azotowy(V) z azotanu może zostać wydzielony za pomocą ciepła, a miedź przez strącenie. Należy pamiętać, że ten sam pomysł został wyrażony już przez van Helmonta. Definiując pierwiastek R. Boyle pisze:
„Mam na myśli Żywioły, tak jak ci Chymiści, którzy mówią według swoich Zasad, o pewnych Prymitywnych i Prostych lub zupełnie nie mieszających się ciałach, które nie są zbudowane z żadnych innych ciał ani z siebie samych, są Składnikami, z których wszystkie te, które nazywają doskonale wymieszanymi Ciałami są zbudowane, i które są łączone i na które ostatecznie zostają rozdzielone.” Przez „doskonale wymieszane ciała” rozumie związki chemiczne odróżniające się od mieszanin mechanicznych. Również „elementy i zasady” oznaczają „te pierwotne i proste ciała, o których mówi się, że są złożone, i do których ostatecznie zostały rozdzielone”. Argumentuje z pewnym prawdopodobieństwem, że działanie ognia na ciała, poprzednio stosowane jako metoda rozdziału na elementy, jest niewystarczająca do tego celu.
R. Boyle nie był tak jasny i przekonywujący w swojej dyskusji na temat pierwiastków chemicznych, jak można by było sobie życzyć w jego czasach. Nadal wydaje się, że uważa różne pierwiastki za złożone z materii pierwotnej, a różne właściwości pierwiastków mogą wynikać z różnych kształtów i ruchów cząstek tej materii. Nie sporządził żadnego zestawienia ciał, które uważał za spełniające jego definicję pierwiastka, takich jak złoto, miedź czy siarka. Gdyby to zrobił to niewątpliwie niektórzy chemicy bez wątpienia przyjęliby jego schemat, ale pozostawił zagadnienie w bardzo nieokreślonej formie, i w żadnych swoich pismach nie mówi, czym tak naprawdę były dla niego pierwiastki. W jego tekstach pojawiają się fragmenty, które pozwalają przypuszczać, ze wierzył on w teorię atomową, oczywiście w formie prezentowanej przez greckich filozofów. Uważał, że między podstawowymi cząstkami budującymi materię występują oddziaływania chemiczne, i prezentuje kilka przemyśleń na temat powinowactwa chemicznego. Pisze: „Istnieją grupy, w których cząsteczki nie są utrzymywane tak blisko siebie, ale mogą spotykać się z innymi cząstkami, z którymi mogą tworzyć grupy silniej związane niż ze sobą nawzajem”.
Zainteresowanie R. Boyle'a działaniem ciśnienia na powietrze doprowadziło go w 1662 roku do odkrycia prawa nazwanego jego imieniem, zgodnie z którym objętość gazu jest odwrotnie proporcjonalna do ciśnienia. Udowodnił to eksperymentalnie zarówno dla ciśnień wyższych jak i mniejszych niż ciśnienie atmosferyczne. W pierwszym przypadku przy użyciu dobrze znanego układu U rurek wypełnionych rtęcią, a w drugim przypadku prostej szklanej rurki zawierającej trochę powietrza uwięzionego nad rtęcią, którą zanurzał w naczyniu z tym metalem. Prawo to zostało niezależnie odkryte przez E. Mariotte’a w roku 1676, i dlatego nosi nazwę prawa Boyle’a–Mariotte’a. Aby wyjaśnić ściśliwość powietrza Boyle porównał cząstki gazu do małych zwiniętych sprężyn, kłębków wełny lub małych gąbek, przy czym dolne „sprężyny” w kolumnie powietrza są ściśnięte przez ciężar tych nad nimi. (Mariotte stosuje te same analogie.) Zauważa również, że ciśnienie można wyjaśnić jako ruch cząsteczek, jak zakładał Kartezjusz: „Niespokojne poruszenie tej materii niebieskiej [eteru], w której cząstki pływają, więc wiruje otaczają się nawzajem, jakby każde z ciał starało się odepchnąć wszystkich innych od wejścia do małej sfery wymaganej do ruchu wokół własnego centrum” – miał bardzo wysokie zdanie o Teorii Wirów Kartezjusza.
R. Boyle doszedł do wniosku, że powietrze składa się z co najmniej trzech części:
- Pary pochodzącej z wody i żywych zwierząt.
- Bardzo subtelnej emanacji magnetyzmu ziemskiego, wywołującej wrażenie światła.
- Płynu, ściśliwego i rozciągliwego, mającego masę i zdolnego do załamania światła.
Pierwsze eksperymenty dotyczące spalania przeprowadził Boyle we współpracy z Hookem, który był jego asystentem w Oksfordzie, a w 1659 r. opracował modyfikację pompy powietrznej wynalezionej w 1654 r. przez Otto von Guerickego. W swoich nowych eksperymentach dotyczących relacji między płomieniem i powietrzem (1673) Boyle opisał eksperymenty spalania w zbiorniku, z którego wypompowano powietrze.. Metoda badań polegała na umieszczeniu rozpalonej do czerwoności żelaznej płyty pod kloszem, z którego powietrze mogło być usuwane przez pompę powietrzną, a następnie upuszczanie palnego materiału na gorącą płytę za pomocą urządzenia zamocowanego u wylotu zbiornika. Podczas prób z siarką owiniętą w papier i opuszczoną na rozgrzaną blachę widać było opary, ale nie pojawiał się płomień. Jednak po doprowadzeniu do zbiornika powietrza R. Boyle zobaczył „niewielkie rozbłyski, których niebieski kolor sugerował płonącą siarkę”. Opisuje gaśnięcie płomienia świecy i płonącego wodoru, i był skłonny myśleć, że płomień nie mógłby istnieć bez dostępu powietrza. Eksperyment z wodorem jest interesujący gdyż wykorzystał w nim wodór wydzielający się z kwasu solnego i opiłków żelaza, zauważając, że po pewnym czasie nie udaje się zapalić wodoru bez wymiany powietrza w naczyniu. Spalanie wodoru będącego wynikiem reakcji żelaza z rozcieńczonym kwasem siarkowym zostało później opisane przez Nicolasa Lemery'ego (1700).
R. Boyle uzyskał ciekawe wyniki badając spalanie prochu. Po upuszczeniu na podgrzaną płytkę w naczyniu pod zmniejszonym ciśnieniem proch płonął powoli, ale nie wybuchał: „Widzieliśmy dość szeroki niebieski płomień podobny do płomienia palącej się siarki, który trwał tak długo, że nie mogliśmy się temu nadziwić”. Pierścień wykonany z prochu palił się w próżni tylko w miejscu, w którym został ogrzany przez skupione promienie słoneczne, ale po wpuszczeniu powietrza całość zapłonęła błyskawicznie (Expt. V: About an endeavour to fire gunpowder in vacuo with the sun beams”). R. Boyle początkowo myślał, że odrobina powietrza zostaje na kryształach saletry użytych do wytworzenia prochu, ale uzyskał taki sam wynik z prochem wykonanym z saletry krystalizowanej w próżni. Doszedł do wniosku, że substancje mogą się palić zmieszane z saletrą nawet przy braku powietrza, i że to saletra podczas ogrzewania wytwarza „palne opary, które naśladują powietrze”. Na przełomie lat 1681-1682 R. Boyle zauważył, że blask fosforu stopniowo zanika gdy jest on przechowywany w zatopionej szklanej rurce, i doszedł do wniosku, że „w powietrzu znajdowały się jakieś niezbędne substancje, które oddziaływały z parami fosforu”.
W 1673 roku Boyle opublikował New Experiments to make Fire and Flame Stable and Ponderable, w którym opisuje wzrost masy metali podczas kalcynacji na powietrzu. Ten fakt był znany przed jego czasami i jest wspominany przez uczonych już w XVI wieku. R. Boyle stwierdził, że 227 gram cyny po podgrzaniu w otwartej kolbie, zwiększa ciężar o około 1 grama. Próbował umieścić cynę w retorcie, zważyć, a następnie uszczelnić szyję i nagrzać, ale z powodu rozszerzania się powietrza retorta pękła „z hałasem przypominającym odgłos pistoletu”. Następnie podgrzał 57 gram cyny w otwartej retorcie, i uszczelniał szyję gdy jak najwięcej powietrza zostało wypchnięte z kolby przez ciepło. Po podgrzaniu w celu wyprażenia cyny retortę ochłodzono i odcięto szyję, a Boyle „usłyszał napływ powietrza do wewnątrz, ponieważ po wstępnym ogrzewaniu przed zamknięciem naczynia powietrze zostało z niego usunięte”. Niestety nie opracował poprawnej teorii, że powietrze wchodzi w reakcję z prażonym materiałem, a zamiast tego doszedł do wniosku, że wzrost masy kalcynowanej cyny wynikał z „działania ognia na metal”. Postulował, że drobiny ognia przeszły przez szkło i zostały wchłonięte przez metal, a co za tym idzie doszedł do wniosku, że ogień ma ciężar. Dokonał natomiast ważnej obserwacji, że gęstość substancji po kalcynacji (wapna) jest mniejsza niż gęstość metalu.
Teoria przyjęta przez Boyle'a w celu wyjaśnienia wzrostu masy metali podczas kalcynacji, a mianowicie przyłączanie posiadających masę cząstek ognia została przyjęta przez J. J. Bechera, N. Lemery'ego i innych, ale w 1679 została skrytykowana przez Chérubina d'Orléansa francuskiego wytwórcę instrumentów naukowych, który twierdził, że Boyle powinien zważyć retorty przed otwarciem i argumentował, że posiadająca masę materia nie może przedostać się przez szkło. R. Boyle odpowiedział Ch. d'Orléans w liście, w którym znajduje się zaskakujące stwierdzenie, że kiedyś przeprowadził ważenie przed otwarciem retorty, i także w tym przypadku zauważył wzrost ciężaru. Nieadekwatność teorii Boyle'a została udowodniona przez J. Kunckela, który wykazał, że próbka żelaza miała taką samą masę, gdy była rozpalona do czerwoności, jak gdy była zimna; podobne eksperymenty zostały przeprowadzone przez H. Boerhaave’a.
Rozpatrzmy inne eksperymenty tego uczonego. W roku 1664 (Experiments . . . Touching Colours) i w 1675 (Refections upon the Hypothesis of Alcali and Acidum) Boyle podaje pewne ogólne właściwości kwasów i zasad, takie jak kwaśny smak kwasów, ich działanie jako rozpuszczalników, ich wytrącanie siarki z mieszaniny siarczków, ich działanie na barwniki roślinne (wskaźniki), takie jak sok z fiołków i wywary z koszenili i drewna brazylijskiego, kolory są przywracane przez alkalia. Ponadto opisuje reakcje zobojętniania, w których zanikają charakterystyczne właściwości kwasów i zasad i powstają obojętne sole.
Boyle opisuje wiele reakcji charakterystycznych stając się tym samym jednym z prekursorów analizy jakościowej. Wspomina zielony kolor nadany płomieniowi przez sole miedzi, białe opary wytwarzane przez amoniak z kwasami azotowymi(V) i chlorowodorowymi (wspomniane już przez J. Kunckela), czarny kolor wytwarzany z solami żelaza przez wywar z galasów (dobrze znaną Pliniuszowi), biały osad tworzony przez sole wapnia z kwasem siarkowym(VI) i wytrącanie soli srebra przez chlorki. Większość z nich była wcześniej znana. Boyle uzyskał bezwodny chlorek miedzi(II) i chlorek bizmutu(III) przez ogrzewanie odpowiednio miedzi i bizmutu („szkło cynowe”) z sublimatem (chlorek rtęci(II)), i wspomina wytrącanie zawiesiny z roztworu bizmutu w kwasie azotowym(V) przez wodę. Wykazał, że pewne zasady (węglan amonu) podczas destylacji z wapnem tracą właściwość musowania kwasami. Twierdził, że alkalia w popiołach roślinnych nie były obecne w roślinie przed spaleniem, lecz powstawały w wyniku spalania. Wykazał, że olej witriolu (kwas siarkowy(VI))) wydziela siarkę po destylacji z terpentyną, ale jednoznacznie nie pisze, czy siarka jest składnikiem tego kwasu.
Dokonał oznaczeń ciężaru właściwego wielu cieczy i ciał stałych, zastosował mieszaniny oziębiające (np. kwas azotowy(V) i śnieg). W 16654 r. opisuje destylację cukru ołowianego (octan ołowiu(II)) i stwierdza, że płyn (zawierający aceton) pochodzi z octu, który zawartego w octanie ołowiu(II), wspomina również strącanie barwników za pomocą ałunu, potażu oraz cukru ołowiowego. W swojej pracy na temat fosforu, Boyle podał następujące istotne wyniki: (1) fosfor świeci tylko w obecności powietrza; (2) o obecności śladowych ilości fosforu (1 na 500 000 części wody) świadczy obserwowalna poświata; (3) fosfor tworzy kwas, który różni się od znanego kwasu fosforowego(V) (fosfina powstająca z kwasu fosforawego(V)); (4) poświatę wykazują roztwory fosforu w oliwie z oliwek i niektórych innych olejach, ale olejki z gałki muszkatołowej i anyżu zapobiegają świeceniu; (5) po długim wystawieniu na działanie fosforu powietrze nabiera silnego zapachu (ozonu).
Poglądy R. Boyle na żywioły, wyrażone w Sceptical Chymist, miały wielki wpływ na myśl chemiczną. Co prawda nie są one często wymieniane przez chemików, którzy podążyli za Boylem, ale ich implikacje są widoczne, chociaż zwolennicy J. Bechera i G. Stahla, twórcy teorii flogistonowej opierają się na czterech elementach i teoriach z czasów alchemii.