 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Odkrycie i badanie gazów
Odkrycie i badanie gazów
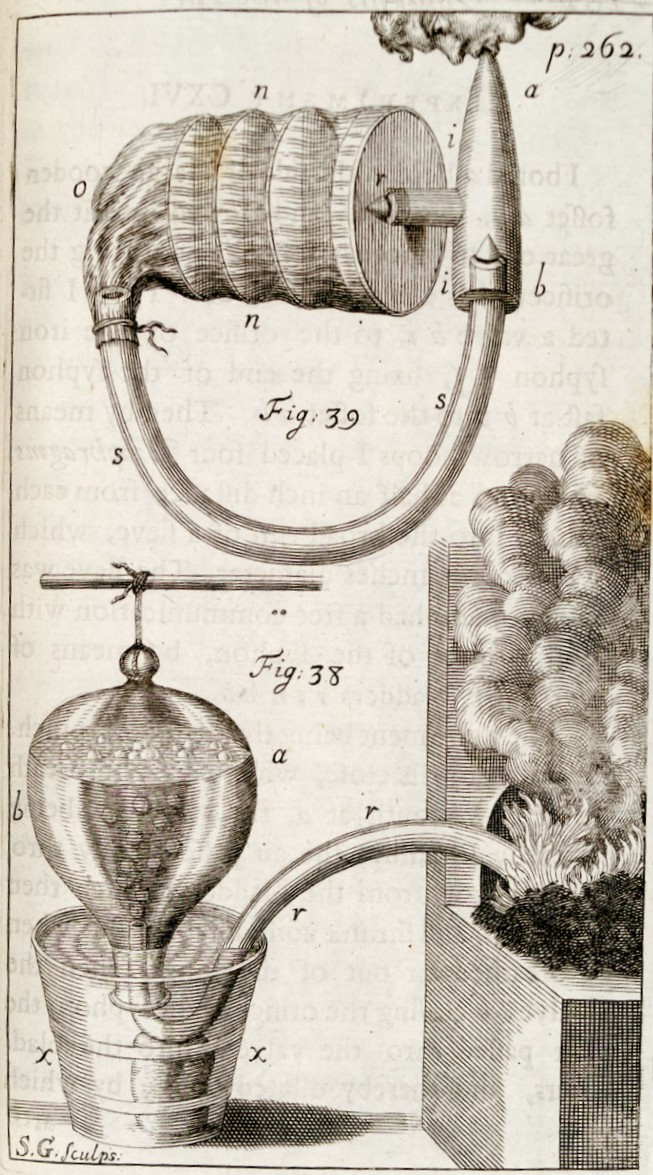
Łatwo można zrozumieć, dlaczego odkrycie gazów i badanie ich nastąpiło dość późno w historii chemii. Van Helmont, wprowadził pojęcie „gaz” około 1630 r., i opisał co najmniej dwa gazy – gas sylvestre (dwutlenek węgla) i gas pingue (zanieczyszczony wodór, lub gaz bagienny) – był zdania, że gazu nie można zebrać w naczyniu. Robert Boyle był prawdopodobnie pierwszym, który dokonał zebrania gazu. Wiedział również, że gazowy wodór jest łatwopalny. Proces przetłaczania powietrza z jednego zbiornika do drugiego przy użyciu wody został opisany przez inżyniera (a przynajmniej tak sam o sobie mówił), a właściwie demonstratora doświadczeń fizycznych Moitrela d'Element w 1719 r. Wielebny Stephen Hales w 1727 r. opublikował swoje badania nad parciem korzeniowym, opisując również kilka eksperymentów na gazach, ale zadowalał się mierzeniem ich objętości bez badania ich właściwości, i dlatego nie zdołał stwierdzić istnienia odrębnych gazów. Chociaż urządzenia jakie zaprojektował do zbierania gazów nad wodą prezentowały ogromny postęp techniczny, który stał się podstawą do konstrukcji urządzeń wykorzystanych później przez Williama Brownrigga, Henry’ego Cavendisha i Josepha Priestleya w ich badaniach.
„Ustalone powietrze” (dwutlenek węgla) zostało ponownie odkryte przez Josepha Blacka w 1754 roku, a gaz ten, a także palne powietrze (wodór) odkryte przez R. Boyle'a zostały dokładnie zbadane w 1766 roku przez H. Cavendisha, który opisał kilka metod pracy z gazami, oraz jako pierwszy zebrał rozpuszczalny w wodzie gaz nad rtęcią. Joseph Priestley skonstruował od 1770 r. wiele urządzeń wykorzystywanych obecnie do pracy z gazami. Odkrył wiele nowych gazów, a oprócz zbierania ich nad wodą posługiwał się rtęcią do gromadzenia gazów rozpuszczalnych w wodzie (amoniak, kwas solny, dwutlenek siarki) nad rtęcią.
Stephen Hales
 Ilustracja z S. Hales Vegetable Staticks, (1727)Stephen Hales, studiował w Corpus Christi College w Cambridge, był wikariuszem w dzielnicy Londynu Teddington, odmówił kanonii w Windsorze, aby poświęcić się naukowym eksperymentom i obowiązkom parafialnym, zajmując się głównie botaniką. W swoich dwóch książkach: Vegetable Staticks (1727) i Haemastaticks (1733) znalazło się kilka interesujących spostrzeżeń chemicznych. Jego prace chemiczne, prawdopodobnie pod wpływem I. Newtona, mają charakter ilościowy, i stanowią przykład uzyskania mało interesujących wyników uzyskanych przy zaniedbaniu jakościowych właściwości chemicznych badanych substancji, ale, jak wspomniano powyżej jego eksperymenty zainspirowały zarówno J. Blacka, jak i J. Priestleya i innych. S. Hales próbował określić ilość „powietrza”, które można wyizolować z różnych substancji podczas ogrzewania, gromadząc wydzielające się gazy nad wodą. Wśród materiałów jakie badał były węgiel (który dawał „gaz węglowy”), czerwona minia i saletra (tlen), opiłki żelaza i rozcieńczony kwas siarkowy(VI) (wodór) oraz opiłki żelaza i rozcieńczony kwas azotowy(V) (tlenki azotu). Różne gazy były dla Halesa „powietrzem”; ich objętości zostały zmierzone, a następnie gazy były uwalniane ze zbiornika. W niektórych eksperymentach dotyczących oddychania odkrył, że mógłby od dychać pewną stałą objętością powietrza znacznie dłużej, gdyby między wydechem a wdechem, przepuszczać je przez tkaniny zwilżone roztworem potażu, ale nie kontynuował tego eksperymentu „bojąc się że mogę w ten sposób zranić płuca”. Odkrył, że duża ilość powietrza jest pochłaniana podczas spalania fosforu. Doszedł do niejasnego wniosku, że „powietrze obfituje w substancje pochodzenia zwierzęcego, roślinnego i mineralnego”, i że obecność powietrza powoduje fermentację substancji organicznych. Pisze, że rośliny czerpią pewną część pożywienia przez liście z powietrza (co później stwierdził również J. Priestley), i podkreślał, że „stan wolny nie jest zasadniczą cechą właściwości cząstek powietrza; ale, jak widzimy, łatwo ulegają zmianie ze stanu wolnego w związany, dzięki silnemu przyciąganiu cząstek kwasu, siarki i soli fizjologicznej, które występują w powietrzu ”, ale także są w stanie ponownie powrócić do stanu wolnego. Uważał powietrze za żywioł
Ilustracja z S. Hales Vegetable Staticks, (1727)Stephen Hales, studiował w Corpus Christi College w Cambridge, był wikariuszem w dzielnicy Londynu Teddington, odmówił kanonii w Windsorze, aby poświęcić się naukowym eksperymentom i obowiązkom parafialnym, zajmując się głównie botaniką. W swoich dwóch książkach: Vegetable Staticks (1727) i Haemastaticks (1733) znalazło się kilka interesujących spostrzeżeń chemicznych. Jego prace chemiczne, prawdopodobnie pod wpływem I. Newtona, mają charakter ilościowy, i stanowią przykład uzyskania mało interesujących wyników uzyskanych przy zaniedbaniu jakościowych właściwości chemicznych badanych substancji, ale, jak wspomniano powyżej jego eksperymenty zainspirowały zarówno J. Blacka, jak i J. Priestleya i innych. S. Hales próbował określić ilość „powietrza”, które można wyizolować z różnych substancji podczas ogrzewania, gromadząc wydzielające się gazy nad wodą. Wśród materiałów jakie badał były węgiel (który dawał „gaz węglowy”), czerwona minia i saletra (tlen), opiłki żelaza i rozcieńczony kwas siarkowy(VI) (wodór) oraz opiłki żelaza i rozcieńczony kwas azotowy(V) (tlenki azotu). Różne gazy były dla Halesa „powietrzem”; ich objętości zostały zmierzone, a następnie gazy były uwalniane ze zbiornika. W niektórych eksperymentach dotyczących oddychania odkrył, że mógłby od dychać pewną stałą objętością powietrza znacznie dłużej, gdyby między wydechem a wdechem, przepuszczać je przez tkaniny zwilżone roztworem potażu, ale nie kontynuował tego eksperymentu „bojąc się że mogę w ten sposób zranić płuca”. Odkrył, że duża ilość powietrza jest pochłaniana podczas spalania fosforu. Doszedł do niejasnego wniosku, że „powietrze obfituje w substancje pochodzenia zwierzęcego, roślinnego i mineralnego”, i że obecność powietrza powoduje fermentację substancji organicznych. Pisze, że rośliny czerpią pewną część pożywienia przez liście z powietrza (co później stwierdził również J. Priestley), i podkreślał, że „stan wolny nie jest zasadniczą cechą właściwości cząstek powietrza; ale, jak widzimy, łatwo ulegają zmianie ze stanu wolnego w związany, dzięki silnemu przyciąganiu cząstek kwasu, siarki i soli fizjologicznej, które występują w powietrzu ”, ale także są w stanie ponownie powrócić do stanu wolnego. Uważał powietrze za żywioł
Joseph Black
Joseph Black urodził się w Bordeaux, gdzie jego ojciec prowadził firmę winiarską. Joseph kształcił się w dziedzinie medycyny na Uniwersytecie Glasgow (1746), gdzie znalazł się pod wpływem dr Cullena, profesora medycyny i wykładowcy chemii oraz praktykującego lekarza, w którego laboratorium pracował J. Black. W 1750 lub 1751 r. Black przeprowadził się do Edynburga, gdzie w czerwcu 1754 r. przedstawił swoją pierwszą rozprawę: De Humore Acido a Cibis orto, et Magnesia Alba („O kwasowym humorze wynikającym z jedzenia i magnezji białej”). Zawarł w niej dodatek z eksperymentami chemicznymi dotyczącymi wyjaśnienia związku między słabymi i żrącymi alkaliami. Tekst został odczytany, w wersji rozszerzonej, w języku angielskim, na zebraniu Philosophical Society of Edinburgh w czerwcu 1755 r., i opublikowany w roku 1756 pod tytułem „Eksperymenty z magnesia alba, wapnem i niektórymi innych substancjami alkalicznymi”. W 1750 r. J. Black zastąpił Cullena na stanowisku profesora anatomii, a wykładowcą chemii w Glasgow został w 1756 r., zamieniając prowadzenie katedry anatomii na stanowisko profesora medycyny. W 1766 roku przejął stanowisko Cullena, jako profesor chemii, w Edynburgu. piastują to stanowisko do swojej śmierci w 1799 r.. Ostatni wykład wygłosił w roku akademickim 1796–7. Jako wykładowca J. Black był bardzo popularny, przykładając się zarówno do prowadzenia swoich kursów, jak i eksperymentów prezentowanych podczas wykładów. Jednym z jego uczniów był Benjamin Rush (1745–1813), który od 1799 r. został pierwszym profesorem chemii w Stanach Zjednoczonych (Filadelfia). Black nie miał przykładał większego znaczenia dla hipotez, które nie były oparte na eksperymencie: z zadowoleniem przyjął poglądy A. Lavoisiera i prowadził swoje wykłady zgodnie z nimi. Wykłądy J. Blacka były tak popularne, że studenci opracowali je i opublikowali anonimowo w Londynie już w roku 1770 pod tytułem: „An Enquiry into the General Effects of Heat, with Observations on the Theory of Mixture”. Szersze opracowanie jego wykładów, 2 tomy in quarto, ukazało się w 1803 roku w Edynburgu: „Lectures on the Elements of Chemistry, delivered in the University of Edinburgh ; by the late Joseph Black, M.U., now published from his Manuscripts”. J. Black przeprowadził jako pierwszy eksperymenty dotyczące ciepła właściwego i ciepła przemiany, które wstępnie wyjaśniał w ramach wykładów z roku 1758 r. i dopracował dwa lata później. Jego poglądy na ciepło przemiany okazały się bardzo istotne dla Jamesa Watta, który w 1765 r. skonstruował ulepszony silnik parowy.
 XVIII-wieczne laboratorium chemiczne, rycina na okładce Commercium Philosophico-Technicum, William Lewis (pomiędzy 1763 i 1766 rokiem)
XVIII-wieczne laboratorium chemiczne, rycina na okładce Commercium Philosophico-Technicum, William Lewis (pomiędzy 1763 i 1766 rokiem)
Rozpatrzmy teraz eksperymenty J. Blacka dotyczące magnezji. Pokazał on, że podczas ogrzewania magnesia biała (zasadowy węglan magnezu, xMgCO3.yMg(OH)2.2H2O) uwalnia gaz, który nazwał „ustalonym powietrzem” i że był to ten sam rodzaj gazu, który van Helmont nazwał gas sylvestre. Pozostałość po kalcynacji magnezji (MgO) jest lżejsza niż magnezsia alba i bardziej alkaliczna. Ważąc tlenek magnezu w retorcie szklanej i ogrzewając, stwierdził, że „z tylko niewielką lotną częścią tego proszku stanowi woda; … lotna materia utracona podczas kalcynacji magnezji to głównie powietrze, a zatem kalcynowana magnezja nie wydziela powietrza ani nie burzy się po zmieszaniu z kwasami.”
A zatem:
magnesia alba = kalcynowana magnezja + woda + ustalone powietrze;
magnesia alba + kwas = sól magnezji + ustalone powietrze;
kalcynowana magnezja + kwas = sól magnezjowa.
Black wspomina, że S. Hales „udowodnił, że sole alkaliczne zawierają dużą ilość ustalonego powietrza, które wydzielają, w ogromnej ilości po połączeniu z czystym kwasem”. Podobnie J. Black również dokonał szereg eksperymentów badając utratę wagi w procesach gdy magnesia alba była traktowana kwasem. W następnym kroku uwagę na wapień i wapno palone oraz łagodne i żrące zasady. Odkrył, że wapień pieni się poddany działaniu kwasów, wydzielając ustalone powietrze. Podczas kalcynacji powstaje wapno palone i (w przeciwieństwie do magnesia alba) niewielkie (śladowe) ilości wody, co oznacza, że utrata masy wapienia musi być spowodowana wydzielaniem ustalonego powietrza zgodnie z równaniem:
wapień = wapno palone + ustalone powietrze
W czasach J. Blacka znano trzy alkalia: roślinne (potaż), morskie (soda) i lotne (amoniak) oraz łagodną i żrącą formę każdego z nich. Wiadomo, że łagodna postać (węglan) przekształca się w postać żrącą (wodorotlenek) przez obróbkę wapnem gaszonym. P. Duhamel w 1736 r. i J. Marggraf w 1757 r. opracowali chemiczne testy pozwalające rozróżnić potaż i sodę, a Duhamel w 1747 r. wykazał utratę wagi próbki wapienia podczas kalcynacji, i wzrost wagi wapna palonego wystawionego na działanie powietrza. J. Black stwierdził, że jeśli daną masę wapienia wygrzeje się do wapna palonego, następnie wapno palone podda się działaniu wody, a uzyskane wapno gaszone gotuje się z roztworem łagodnych zasad (węglanu potasu), zasady stają się żrące a początkowa masa wapienia zostaje odzyskana:
wapno palone + łagodna zasada = wapień + żrąca zasada
Te dwa powyższe równania połączył w jedno:
łagodna zasada = żrąca zasada + ustalone powietrze
pisząc: „Jeśli wapno palone zmiesza się z rozpuszczonym alkaliami, wykazuje ono większe powinowactwo do ustalonego powietrza w porównaniu z alkaliami. Okrada ono tę sól z ustalonego powietrza i tym samym staje się łagodne, podczas gdy alkalia stają się w konsekwencji bardziej korozyjne, lub też odkrywa w ten sposób swoją naturalną tendencję do silnego przyciągania wody; która to tendencja jest mniej widoczna, gdy wapno było nasycone powietrzem. A lotna zasada (węglan amonu), pozbawiona powietrza, oprócz przyciągania różnych ciał, uwidacznia również swój naturalny stopień lotności, który wcześniej był mniej widoczny za sprawą przylegającego do niego powietrza, w taki sam sposób, jak jest tłumiony dodaniem kwasu.” W dalszym ciągu tekstu czytamy: „ponieważ ziemie wapienne i zasady silnie przyciągają kwasy i mogą być nimi nasycone, więc przyciągają również ustalone powietrze, i w ich zwykłym stanie są nim nasycone: a kiedy mieszamy kwas z zasadą lub ziemią, powietrze zostaje uwolnione … ponieważ ciało alkaliczne przyciąga go słabiej niż kwas, i ponieważ kwas i powietrze nie mogą być połączone z tym samym ciałem jednocześnie”. Kiedy wapień rozpuszcza się w kwasie, stałe powietrze wydziela się i powstaje sól. Po dodaniu do roztworu łagodnych alkaliów pierwotna masa wapienia jest ponownie wytrącana i nie występuje pienienie roztworu, ponieważ ustalone powietrze łagodnych alkaliów łączy się z wapnem palonym, tworząc wapień. Wapno gaszone nie zawiera żadnych silniej żrących części, a „ponieważ dowolną jego część można rozpuścić w wodzie, całość można również rozpuścić”. Alkalia żrące nie zawierają wapna ani innych jego części, które można by rozpuścić w wodzie.
„Wapno palone nie przyciąga powietrza w zwykłej postaci, ale można je połączyć tylko z jednym konkretnym jego gatunkiem ... dlatego nadałem mu nazwę ustalonego powietrza, być może postąpiłem bardzo niewłaściwie; ale pomyślałem, że lepiej jest użyć słowa znanego z filozofii, niż wymyślić nową nazwę, zanim będziemy mogli lepiej poznać naturę i właściwości tej substancji.” Należy zauważyć, że definicja ustalonego powietrza J. Black'a jest identyczny z definicją gazu van Helmonta, i, czego Black nie ukrywa, został zapożyczona od tego autora.
Teorii Blacka sprzeciwiał się niemiecki chemik Johann Friedrich Meyer w 1764 r. w książce o rozwlekłym, charakterystycznym dla tej epoki, tytule: „Chymischen Versuche zur nöheren Erkenntniss des ungelöschten Kalchs, der elastichen und elektrischen Materie, des allerreinsten Feuerwesens, und der ursprünglichen allgemeinen Saure”. W tekście tym Meyer wyjaśnia, że wapień podczas palenia pobiera z ognia kwaśny olej (acidum pingue), który nadaje żrącym alkaliom charakter łagodnych zasad. Ponieważ wapień i alkalia zawsze reagują z kwasami wydzielając gaz, wynika z tego, że wapno palone i żrące alkalia, które w reakcjach z kawasami nie wydzielają gazu są już nasycone acidum pingue. Teorii Blacka bronił N. J. Jacquin (1769) i zaakceptował ją C. F. Wenzel (1777). Teorię Meyera poparli J. Ch. Wiegleb (1767), G. Cranz (1770) i D. de Smeth (1772). A. Lavoisier (Opusules Physiques et Chimiques, 1774) chwalił pracę Meyera, i przypisywał N. J. Jacquinowi znaczną część dokonań J. Blacka.
J. Black w ramach swoich wykładach pokazał przelewanie ustalonego powietrza zawartego w zlewce na płonącą świecę; wykazał również, że jest ono zawarte w wydychanym powietrzu dmuchając przez rurkę do roztworu wody wapiennej, która ulega zmętnieniu, oraz że powstaje ono w procesie przedmuchiwania powietrza przez rozgrzany do czerwoności węgiel drzewny. D. Macbride dokonał kilku dalszych eksperymentów z ustalonym powietrzem, a T. Bergman w 1774 r. opublikował długą rozprawę na ten temat, nazywając go „lotnym kwasem”. J. Priestley w 1772 r., pisze: „To nie jest nieprawdopodobne, ale to ustalone powietrze może mieć charakter kwaśny, choć słabego i osobliwego rodzaju. Pan Bergman z Uppsali, który uhonorował mnie listem na ten temat. . . mówi, że zmienia niebieski kolor lakmusu na czerwony.” J. Black już wcześniej twierdził, że ustalone powietrze zachowuje się jak kwas, zbadał jego wpływ na zwierzęta, jego powstawanie w procesach oddychania i fermentacji oraz spalania węgla drzewnego, a ponadto wywnioskował obecność jego niewielkich ilości w atmosferze w roku 1757.