 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Początki chemii organicznej
Początki chemii organicznej
Na początku dziewiętnastego wieku chemia związków węgla była znacznie mniej zaawansowana niż w przypadku metali i pospolitych pierwiastków, takich jak siarka, fosfor i azot. Wiedzę na temat związków organicznych podzielono na dwie grupy chemię roślinną i chemię zwierząt, a na przykład w podręcznikach Thomsona i Berzeliusa znajdujemy różne składniki roślin i zwierząt opisane bez wskazywania związków między ich składem chemicznym. W chemii roślinnej cukier, kwasy, guma, indygo, garbniki, kamfora i wskaźniki wymagają osobnego opisu; i podobnie w chemii organizmów zwierzęcych żelatyna, albumina, fibryna, mocznik, krew, ślina, mocz i tym podobne są opisane głównie z punktu widzenia lekarza. Uświadomiono sobie, że wszystkie te materiały zawierają węgiel i wodór, czasami tlen, azot i siarkę, jako niezbędne składniki, ale sposoby wydzielania i charakterystyka określonych substancji była skromna. Kilka tak zwanych „bezpośrednich zasad” materii roślinnej i zwierzęcej, np. takie jak cukier, guma, kamfora itp., które można ekstrahować rozpuszczalnikami lub innymi prostymi metodami, zbadali A. F. Fourcroy i L. N. Vauquelin, którzy również odkryli nowe substancje. Wiele substancji nie mogło zostać skrystalizowanych, ich oczyszczenie stanowiło ogromne trudności, a ich analizy była szczątkowe. Możemy zatem zrozumieć F. Wohlera, który w 1835 r. pisze do Berzeliusa, że „chemia organiczna wydaje mi się jak pradawny las tropików pełen najbardziej niezwykłych rzeczy.” Wejście do ciemnego lasu i wycięcie zarośli było zadaniem, któremu chemicy po raz pierwszy oddali się na poważnie, a odkrycia jakich dokonali miały na celu zmianę całego aspektu chemii.
Pojedyncze badania związków węgla datują się na znacznie wcześniejszy okres. Alkohol jest opisany w manuskrypcie z XII wieku; eter został opisany w pracy Valeriusa Cordusa (zm. 1544), a Boyle, w Sceptical Chymist (1661), opisuje rozdział destylatu z bukszpanu na kwas i „adiaforycznego ducha”, którego nie powstrzymuje destylacja nad solą i kamieniem. Najprawdopodobniej były to alkohol metylowy i aceton. Kwas benzoesowy został opisany przez Blaise'a de Vigenere (1522–1596) w pracy opublikowanej w 1618 r. Badania Scheele’go (1742–1786) doprowadziły do odkrycia wielu kwasów organicznych w roślinach i owocach, gliceryny (która, jak wykazał, jest powiązana z cukrem zarówno ze względu na słodki smak, jak i poprzez tworzenie kwasu szczawiowego po utlenieniu kwasem azotowym(V)), kwasu cyjanowodorowego i estrów przez destylację kwasów z alkoholem. Wykazał, że estry zostawały „zmydlone” w wyniku gotowania z alkaliami.
Lavoisier uważał, że substancje organiczne powstają w ten sam sposób co nieorganiczne: w szczególności substancje zawierające tlen nazywał rodnikami (nazwa po raz pierwszy użyta w nowoczesnym sensie przez L. B. G. de Morveau w 1787 r.). Rodnik w prostszych związkach składał się z węgla i wodoru („rodnik węglowodorowy”) i można go łączyć z różnymi proporcjami tlenu: cukier był niższym, a kwas szczawiowy wyższym tlenkiem rodnika węglowodorowego. Oleje uważane za wolne od tlenu mogą być uważane za wolne rodniki. Istnienie rodnika organicznego być może po raz pierwszy wyraźnie wykazane zostało w badaniach J. Gay-Lussaca nad związkami cyjanogenu w 1815 r.
W 1817 r. Berzelius rozszerzył swoją dualistyczną teorię na związki organiczne. „Wszystkie substancje organiczne są tlenkami złożonych rodników. Rodniki substancji roślinnych składają się zasadniczo z węgla i wodoru, a substancji zwierzęcych z węgla, wodoru i azotu.”
W 1784 r. A. Lavoisier opracował metodę analizy substancji organicznych poprzez spalenie ich w małej lampce unoszącej się na powierzchni rtęci w naczyniu zawierającym powietrze wzbogacone tlenem, przy czym dwutlenek węgla był absorbowany przez roztwór potażu. Wiedział także, że kwas octowy, otrzymany w stanie czystym (lodowaty kwas octowy) przez G. E. Stahla, powstał w wyniku utlenienia alkoholu co ujawniło zależność między tymi dwiema substancjami. J. Dalton w 1804 r. przeprowadził analizy gazów węglowodorowych, spalając je w tlenie w eudiometrze, i w ten sposób określił wzory metanu i etylenu. Pierwszą zadowalającą metodę analizy organicznej opracowali J. Gay-Lussac i L. J. Thenard w 18101 r. Zmieszali oni substancję organiczną z chloranem(V) potasu, uformowali mieszaninę do postaci pastylki i umieścili ją w pionowo ustawionej podgrzewanej rurce, a wydzielający się gaz analizowali. Zawartość wodoru obliczono na różne sposoby. Stwierdzono, że w substancjach takich jak cukier i skrobia wodór i tlen łączyły się ze sobą w odpowiednich proporcjach tworząc wodę, i takie związki zostały nazwane przez C. E. H. Schmidta w 1844 r. „węglowodanami” (węgiel + woda). Kwasy zawierały nadmiar tlenu, a oleje nadmiar wodoru. Metodę tę zastosowano również do związków organicznych zawierających azot, który mierzono jako ilość gazu pozostającą po pochłonięciu dwutlenku węgla, przy czym do utlenienia węgla i wodoru wykorzystano wystarczającą ilość chloranu(V) unikając jego nadmiaru.
Istnienie zasad organicznych zawierających azot, po raz pierwszy wykazano w wyniku izolacji morfiny przez F. Sertürnera z opium w 1805 r. i jej identyfikację jako zasady w 1816 r .; alkaloidy strychnina, brucyna, chinina i cynchonina zostały wszystkie wyizolowane przez D. Pelletiera i J. B. Caventou do 1820 roku. Zagadnienie, czy substancje organiczne podlegają prawom składu substancji chemicznych, zostało rozpatrzone przez Daltona w 1803 roku, który nadał niektórym z nich następujące wzory (zgodnie ze współczesną notacją): etylen CH, eter C2O, alkohol CH2O, cukier CHO2.
J. J. Berzelius, w badaniach, podjętych w latach 1814-15, mających na celu ustalenie, czy prawa składu obowiązują w świecie organicznym udoskonalił metody analizy tych substancji. Ogrzewał mieszaninę substancji organicznej, do której dodano zwykłą sól w celu spowolnienia reakcji, z chloranem(V) potasu w szklanej, pochylonej rurce owiniętej blachą i ogrzewanej węglem drzewnym. Rurkę tę połączono z odbieralnikiem i rurką wypełnioną chlorkiem wapnia, w celu zaabsorbowania powstającej wody, oraz ze słojem umieszczonych nad rtęcią, na powierzchni której unosiła się mała, o znanej wadze kolba zawierająca stały potażu żrący (KOH), który pochłaniał dwutlenek węgla. Kwasy analizowano głównie w postaci ich soli ołowiowych, dlatego wzory kwasów były podawane w formie bezwodników. Otrzymano następujące wzory:
Kwas cytrynowy CHO
Kwas winowy C4H5O5
Kwas szczawiowy C12HO18
Kwas bursztynowy C4H4O3
Cukier C12H21O10
Skrobia C7H13O6
Dodatek tlenku miedzi(II) do chloranem(V) przy utleniania związków organicznych został wprowadzony przez J. Gay-Lussaca w 1815 r., i J. W. Dobereinera w 1816 r .; metoda była stosowana i ulepszona przez J. Liebiga i pozostaje zasadniczo taka sama w dobie współczesnej. Metoda szacowania ilości azotu w spalonych próbkach związków organicznych została opracowana w 1830 roku przez J-B. Dumasa.
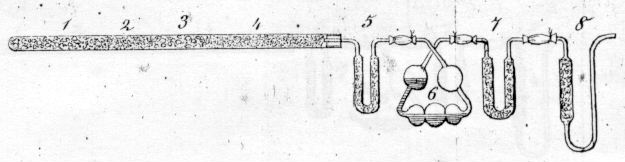 Aparat do analizy związków organicznych Dumasa (rysunek z pracy Annalen der Chemie und Pharmacie, 1841, 38, 141)
Aparat do analizy związków organicznych Dumasa (rysunek z pracy Annalen der Chemie und Pharmacie, 1841, 38, 141)
Analizy Berzeliusa wykazały, że prawa stosunków wagowych i teorię atomową można zastosować do związków organicznych, chociaż mają one często skomplikowane wzory. Wyniki chemii nieorganicznej mogą służyć jako przewodnik w badaniu „sposobu łączenia pierwiastków” w związkach organicznych, a w Traité Lavoisiera są one klasyfikowane jako kwasy, zasady i substancje obojętne. Podkreślił on, że „opisane przez nas zjawiska elektryczne przejawiają się głównie w naturze nieorganicznej; w naturze organicznej stan rzeczy jest inny.” W świecie organicznym założono istnienie tajemniczej „siły witalnej”, która miała działać przy powstawaniu tych związków, a tym samym ich otrzymanie w laboratorium było niemożliwe. Teoria ta otrzymała poważny cios, gdy F. Wöhler w 1828 r. wykazał, że mocznik, typowy związek organiczny, można otrzymać w wyniku prostego ogrzewania cyjanianu amonu (obie substancje są izomerami), ale pogląd o działaniu „siły witalnej” utrzymywał się jeszcze długo po otrzymaniu mocznika.
Michel Eugene Chevreul
Istotne badania związków organicznych przeprowadził urodzony w 1786 r. Michel Eugene Chevreul, który dożył wieku 103 lat. Zaczął pracować nad procesem zmydlana w 1810 roku, biorąc za punkt wyjścia pracę C. Scheele’go. W 1816 r. ustalił, że mydło powstaje w wyniku połączenia zasady z kwaśnym składnikiem tłuszczu (fakt stwierdzony przez Otto Tacheniusa w 1666 r.), a przy tym zostaje uwolniony pewien składnik (glicerol). W 1817 r. we współpracy z H. Braconnotem dokonał rozróżnienia pomiędzy stearyną i płynną oleiną oraz otrzymał kwas stearynowy. W swoich pracach często wykorzystywał oznaczanie temperatury topnienia jako metody identyfikacji substancji organicznych. W latach 1818–1823 uzyskał kwas masłowy, walerianowy i kapronowy oraz zanieczyszczony kwas oleinowy. Jego klasyczne dzieło Recherches chimiques sur les corps gras d'origine animale pojawiło się w 1823 roku, a Considérations générates sur I’analyse organique et sur ses applications w 1824 roku. W późniejszym okresie (1853 r.) badał tłuszcz gromadzący się na włóknach wełny. Badał także różne barwniki, uzyskując hematoksylinę i brazynę z drewna kampeszu, a także kwercytrynę, morinę i luteolinę. W 1812 r. uzyskał biel indygową poprzez redukcję indygo; w 1832 r. wyizolował kreatynę z ekstraktu mięsnego.W wyniku badań L. N. Vauquelina, J. Gay-Lussaca i M. E. Chevreula Paryż zasłynął jako centrum badań w nowej nauce – chemii organicznej.
Gay-Lussac i Thenard
Joseph Louis Gay-Lussac urodził się w St. Leonard w 1778 r., zmarł w Paryżu w 1850 r. Był asystentem C. L. Bertholleta i A. F. de Fourcroya, a później profesorem w École Polytechnique i Jardin des Plantes. Jego wykłady zostały opublikowane w 1828 r. W wielu swoich badaniach współpracował z Louisem Jacques'em Thenardem, urodzonym w 1777 r. w Louptiere. Thenard rozpoczął swoją pracę naukowa jako laborant u L. N. Vauquelina, z czasem zastępując go na stanowisku profesora w College de France. Za sprawą odkrycia błękitu kobaltowego (błękit Thenarda, glinian kobaltu(II)) stał się bogatym człowiekiem; odkrył nadtlenek wodoru (1818). Zmarł w 1857 r.
Gay-Lussac i Thenard w 1808 r. badali działanie gazowego amoniaku na potas i otrzymali amidek tego metalu KNH2. Opracowali metodę otrzymywania znacznych ilości metali alkalicznych w wyniku działania stopionych zasad na rozgrzane do czerwoności żelazo, a przy okazji zaobserwowali obecność wodoru w cząsteczkach alkaliów, które H. Davy uważał za tlenki. Odkryli nadtlenki sodu i potasu. W 1809 r. uzyskali niemal bezwodny kwas fluorowodorowy i fluorek boru, w 1810 nadtlenek baru, a w 1811 r. zaobserwowali absorpcję wodoru przez rozgrzane sód i potas. Gay-Lussac odkrył kwas jodowodorowy i jodan(V) potasu w 1813 r., kwas chlorowy(III) w 1814 r.
W 1815 r. Gay-Lussac opublikował artykuł na temat związków cyjanowych (w owym czasie zwanych cyjanogenowymi). Skład błękitu pruskiego pozostawał w tamtych czasach nieznany. C. Sheele działając na błękit pruski wodą i tlenkiem rtęci otrzymał sól (cyjanek rtęci). Gay-Lussac stwierdził, że podczas ogrzewania wydziela się łatwopalny gaz złożony z węgla i azotu. Gaz ten, który Gay-Lussac nazwał cyjanogenem, okazał się być podstawą szeregu związków, tak zwanych związków cyjanogenowych (cyjanki). Z wodorem tworzył kwas pruski, łączył się z chlorem i jodem, a jego związkami z metalami były prusaniany, zwane obecnie cyjankami. Kwas cyjanowodorowy był przykładem kwasu wolnego od tlenu, a cyjanogen, który pojawiał się we wszystkich badanych związkach, był wolnym rodnikiem organicznym, podobnym do chloru, jak zauważył Berzelius w 1839 r .:
Omawiając chlorek cyjanogenu, Gay-Lussac zauważa, że chlor zastępuje wodór w kwasie cyjanowodorowym: „To bardzo niezwykłe, że dwa ciała, których właściwości są tak różne, odgrywają jednakową rolę w połączeniu z cyjanogenem”, zapowiadając niejako w ten sposób teorię substytucji. W 1814 r. zauważył, że kwas octowy i „matiére ligneuse” (celuloza) mają ten sam skład i doszedł do wniosku, że „rozmieszczenie cząsteczek [atomów] w związku ma największy wpływ na charakter neutralny, kwasowy lub zasadowy związku”- wstępne określenie izomerii. Gay-Lussac wprowadził również wolumetryczne metody kwasometryczne i alkalimetryczne oraz argentometryczne. W 1821 r. wykazał, że można zabezpieczyć drewno przed paleniem nasycając je boraksem, a w 1829 r. uzyskał kwas szczawiowy przez stapianie trocin z zasadami.
Jean Baptiste André Dumas
Jean Baptiste André Dumas urodził się w Alais w 1800 r., zmarł w 1884 r. Został uczniem aptekarza, ale chcąc polepszyć swoją wiedzę, wyruszył pieszo do Genewy, gdzie pracował w laboratorium farmaceutycznym. Genewa była centrum życia akademickiego, a Dumas został zauważony przez Nicolasa Theodore de Saussure i botanika Augustina Pyramusa de Candolle. Studiował również chemię i przeprowadził prace, które przyciągnęły uwagę Auguste Arthura de la Rive, który był wówczas profesorem chemii w Genewie. W 1818 roku Dumas i J-F. Coindet wprowadzili stosowanie związków jodu jako lekarstwa na choroby wola, a wraz z fizjologiem A. F. Prevostem J. B. Dumas przeprowadzał badania różnych problemów fizjologicznych. Wtedy spotkał się z Alexandrem von Humboldtem, w wyniku czego postanowił wyjechać do Paryża, gdzie szybko znalazł swoje miejsce w świecie nauki. Badając właściwości fizyczne cieczy, zainteresował się estrami, a rezultatem tych badań była wspólna z Polydorem Boullayem praca opublikowana w 1827 roku. W 1831 r. wyizolował antracen ze smoły węglowej, w 1832 r. studiował olejki eteryczne i opracował metody wydzielania i otrzymywania kamfory, borneolu i sztucznej kamfory. W 1834 r. wraz z Eugéne-Melchiorem Peligotem otrzymali aldehyd cynamonowy i kwas cynamonowy oraz azotan metylu.