 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Powstanie nowoczesnej chemii
Powstanie nowoczesnej chemii
Antoine Laurent Lavoisier
Antoine Laurent Lavoisier, urodzony w 1743 r. w Paryżu, był synem bogatego adwokata. Kształcił się w College Mazarin. Uczył się astronomii od Nicolasa Louisa de Lacaille i botaniki od Bernarda de Jussieu, studiował geologię u Jean-Étienne Guettarda i chemię u Guillaume-François Rouellego. W 1768 r. został członkiem Francuskiej Akademii Nauk. Od 1775 r. służył w administration royale des poudres, gdzie jego praca doprowadziła do ulepszeń w produkcji prochu strzelniczego i wynalezienia nowej metody produkcji saletry. Duże znaczenie w życiu Lavoisiera miało zainteresowanie prawem, które prowadziło do zainteresowania się polityką. W wieku 26 lat uzyskał stanowisko poborcy podatkowego w Ferme Generale, prywatnym przedsiębiorstwie zajmującym się poborem podatków, gdzie próbował wprowadzić zmiany we francuskim systemie finansowym i podatkowym. Pracując dla rządu, opracowywał system miar mający zapewnić uniformizację wag w całej Francji. Jako jeden z 28 francuskich poborców podatkowych został okrzyknięty przez rewolucjonistów zdrajcą i zgilotynowany w Paryżu w roku 1794.
Lavoisier nie odkrył żadnych nowych substancji, nie opracował nowej aparatury ani ulepszonych metod eksperymentalnych. Był w gruncie rzeczy teoretykiem, a jego ogromne zasługi dla nauki polegały na tym, że był w stanie opracować wyniki prac eksperymentalnych prowadzonych przez innych stosując rygorystyczną, logiczną procedurę, wzmocnioną jego własnymi eksperymentami ilościowymi, podając właściwe wyjaśnienie wyników. Ukończył prace J. Blacka, J. Priestleya i H. Cavendisha podając prawidłowe wyjaśnienie ich eksperymentów.
Metoda ilościowa Lavoisiera
Prace Lavoisiera charakteryzują się systematycznie ilościowym charakterem: stale korzystał z wagi, ale błędem jest twierdzić, że jako pierwszy zastosował metody ilościowe w chemii, ponieważ były one systematycznie stosowane już przez J. van Helmonta, R. Boyle’a i J. Blacka. Badania Blacka były wzorem dla Lavoisiera, jak sam przyznaje w swoich pismach. Taka metoda z konieczności zakłada, że prawo niezniszczalności materii lub zachowania masy jest ważne. Lavoisier stwierdził to w szczególności: „… nic nie jest stwarzane w działaniach tak sztuki jak i natury, i należy przyjąć za aksjomat, że w każdej przemianie istnieje równa ilość materii zarówno przed, jak i po operacja, że jakość i ilość składników pozostają takie same, i że zachodzą tylko ich zmiany i modyfikacje. Cała sztuka przeprowadzania eksperymentów w dziedzinie chemii opiera się na tej zasadzie: zawsze musimy zakładać dokładną równość lub bilans między składnikami badanego ciała a składnikami produktów jego analizy.”
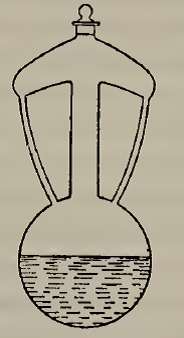 Naczynie A. Lavoisiera do badania wody.Ten „aksjomat” znalazł zastosowanie w tekście Lavoisiera poświęconym naturze wody i możliwości jej przekształcenia w ziemię (On the nature of water and on the experiments which have been supposed to demonstrate the possibility of its conversion into earth) z roku 1770, a opublikowanego w 1773 r. Jako pierwszy takie badania prowadził van Helmont, a po nim wielu chemików wykazało, że po destylacji wody zawsze widać niewielkie ziemiste pozostałości, co miało udowodnić, że część wody została przekształcona w ziemię. Lavoisier ważył szklane naczynie zaopatrzone w rurki zwrotne odprowadzające destylat kondensujący się w górnej części, i wlał do niego odważoną ilość ośmiokrotnie destylowanej wody. Naczynie powoli ogrzewano, a korek zamykający górną część od czasu do czasu był otwierany w wyrównania ciśnienia, na koniec aparat uszczelniono i całość zważono. Naczynie następnie utrzymywano w temperaturze 60-70° Reaumura przez 101 dni. W roztworze pojawiła się biała substancja stała, której ilość rosła z czasem. Na koniec aparat schłodzono i zważono, nie notując zmiany masy całkowitej. Wodę wylano, a naczynie wysuszono i zważono, odnotowując pewien ubytek masy. Wytrącony biały proszek również zważono, a wodę z naczynia odparowano w alembiku i zważono wytrącony osad. Po zsumowaniu wszystkich mas stwierdzono wystąpienie pewnego nadmiaru, który został wyjaśniony jako spowodowany wymyciem przez wodę szkła ze ścianek szklanego alembiku stosowanego do odparowania wody. Lavoisier doszedł do wniosku, że nadmiarowa masa „ziemi” wynikała z rozpuszczenia przez wodę ścian szklanego naczynia, a nie pochodziła z samej wody. Wniosek ten został potwierdzony przez C. Scheele’go, który wykonał analizę jakościową „ziemi”, potwierdzając jej pochodzenie ze szkła naczynia.
Naczynie A. Lavoisiera do badania wody.Ten „aksjomat” znalazł zastosowanie w tekście Lavoisiera poświęconym naturze wody i możliwości jej przekształcenia w ziemię (On the nature of water and on the experiments which have been supposed to demonstrate the possibility of its conversion into earth) z roku 1770, a opublikowanego w 1773 r. Jako pierwszy takie badania prowadził van Helmont, a po nim wielu chemików wykazało, że po destylacji wody zawsze widać niewielkie ziemiste pozostałości, co miało udowodnić, że część wody została przekształcona w ziemię. Lavoisier ważył szklane naczynie zaopatrzone w rurki zwrotne odprowadzające destylat kondensujący się w górnej części, i wlał do niego odważoną ilość ośmiokrotnie destylowanej wody. Naczynie powoli ogrzewano, a korek zamykający górną część od czasu do czasu był otwierany w wyrównania ciśnienia, na koniec aparat uszczelniono i całość zważono. Naczynie następnie utrzymywano w temperaturze 60-70° Reaumura przez 101 dni. W roztworze pojawiła się biała substancja stała, której ilość rosła z czasem. Na koniec aparat schłodzono i zważono, nie notując zmiany masy całkowitej. Wodę wylano, a naczynie wysuszono i zważono, odnotowując pewien ubytek masy. Wytrącony biały proszek również zważono, a wodę z naczynia odparowano w alembiku i zważono wytrącony osad. Po zsumowaniu wszystkich mas stwierdzono wystąpienie pewnego nadmiaru, który został wyjaśniony jako spowodowany wymyciem przez wodę szkła ze ścianek szklanego alembiku stosowanego do odparowania wody. Lavoisier doszedł do wniosku, że nadmiarowa masa „ziemi” wynikała z rozpuszczenia przez wodę ścian szklanego naczynia, a nie pochodziła z samej wody. Wniosek ten został potwierdzony przez C. Scheele’go, który wykonał analizę jakościową „ziemi”, potwierdzając jej pochodzenie ze szkła naczynia.
Eksperymenty dotyczące spalania i kalcynacji
W listopadzie 1772 r. Lavoisier zdeponował w Akademii zapieczętowaną notatkę, która została otwarta w następnym roku. Pisze w niej, że odkrył iż siarka i fosfor zwiększają wagę po spaleniu w powietrzu. (A. S. Marggraf w 1740 r. odkrył to spalając fosfor; Lavoisier nigdy nie wyjaśnił, w jaki sposób uzyskał ten wynik dla siarki). Pisze dalej, że część powietrza jest pochłaniana, co wcześniej, w 1727 r. opisywał S. Hales w odniesieniu do siarki i fosforu. Lavoisier podejrzewał, że „powietrze” jest pochłaniane w procesie kalcynacji metali, ponieważ podczas redukcji glejty (tlenku ołowiu(II)) węglem drzewnym uwalniana jest znaczna ilość „powietrza”.
W Opuscules Physiques et Chimiques (1774 r.), ukończonym w 1773 r., Lavoisier opisuje spalanie fosforu w powietrzu w naczyniu zanurzonym w rtęci. Część powietrza została pochłonięta, ponieważ poziom rtęci w naczyniu podniósł się. W pozostałe w naczyniu powietrzu próba spalenia dodatkowej ilości fosforu nie powiodła się, dodatkowo jeszcze gaz ten gasił płomień świecy. Utworzony ze spalonego fosforu biały proszek (P2O5) był cięższy niż naważka spalonego fosforu, a wzrost masy odpowiadał w przybliżeniu jednej piątej masy zużytego powietrza. Opisuje także eksperyment, w którym wydziela się odpowiednia ilość „elastycznego fluidu” w wyniku redukcji minii ołowianej węglem drzewnym w żelaznej retorcie. Wskazuje na fakt, że jest to ustalone powietrze. W ten sposób cielę bierze się z formowania metalu, a to musi być „powietrze”. Dowodzie w ten sposób, że to skoro z wapna powstaje metal to wydzielane, w tym procesie, musi być „powietrze”.
W kwietniu 1774 r. przedstawił akademii kolejny mémoire, który został przeczytany w listopadzie i opublikowany w grudniowym abstrakcie. W tym tekście opisuje eksperymenty dotyczące kalcynacji cyny i ołowiu w zamkniętych retortach szklanych, ważonych przed i po procesie. Waga nie uległa zmianie, dlatego teoria R. Boyle'a o dołączaniu do metali cząstek ognia została odrzucona. Po otwarciu szyjki retorty do wnętrza naczynia zostało zassane trochę powietrza i nastąpił niewielki wzrost ciężaru, który, jak zakładano, był równy ciężarowi powietrza, które połączyło się z metalem. Eksperymenty i wnioski R. Boyle'a zostały skrytykowane w 1745 r. przez profesora M. Łomonosowa z Petersburga, który wyjaśnił wzrost masy absorpcją powietrza, a w niepublikowanych eksperymentach z roku 1750 stwierdził, że przy kalcynacji w zamkniętej retorcie nie następuje wzrost masy. G. B. Beccaria w 1759 roku wykazał, że ilość cyny lub ołowiu jaką można poddać kalcynowanie w zamkniętym naczyniu wypełnionym powietrzem jest tym większa, im większe jest naczynie. Znacznie zmieniona wersja wniosków Lavoisiera pojawiła się w 1778 r., kiedy to mówi, że powietrze składa się z dwóch elastycznych płynów (C. Scheele opublikował takie doniesienie w 1777 r.), z których jeden łączy się z metalem, a druga część „mefityczna” została błędnie określona jako „bardzo złożona” (fort composée). W grudniu 1774 roku Lavoisier uznawał, że powietrze jako całość łączy się z metalami podczas kalcynacji.
Ale w październiku 1774 r. J. Priestley odwiedził Paryż z lordem Shelburne i podczas kolacji powiedział Lavoisierowi o swoim odkryciu deflogistonowanego powietrza, mówiąc, że „uzyskał go z precipitate per se, jak również czerwonego ołowiu”; po czym, jak pisze, „cała kompania, a także pan i pani Lavoisier jak wszyscy, wyrazili wielkie zaskoczenie”. Lavoisier otrzymał również list od C. Scheele’go, datowany na 30 września 1774 r., w którym prosił go, by spróbował podgrzać węglan srebra za pomocą soczewki, pochłaniając ustalone powietrze, z wydzielające się gazu, wodą wapienną i sprawdzić, czy w pozostałej porcji pali się świeca. C. Scheele wiedział już wtedy, że w ten sposób można uzyskać tlen.
W listopadzie 1774 roku Lavoisier przeprowadził eksperyment zasugerowany przez J. Priestley’a polegający na ogrzewaniu tlenku rtęci(II) za pomocą soczewki. W lutym i marcu 1775 r., powtórzył te eksperymenty, a 26 kwietnia w Akademii odczytano jego sprawozdanie. W maju 1775 r. ogłosił, że składnik, który łączy się z metalami podczas kalcynacji, nie jest częścią powietrza, ale „całym powietrzem” (l’air lui-même entier). Powietrze wydzielone podczas ogrzewania tlenku rtęci(II) ma prawie taką samą gęstość jak zwykłe powietrze i jest pochłaniane przez tlenek azotu(II) w mniej więcej tym samym stopniu (jedna trzecia) jak powietrze atmosferyczne. Powietrze, które łączy się z metalami i wspomaga spalanie i oddychanie, jest „jeszcze czystsze niż powietrze, w którym żyjemy”. Zmieniona wersja tego tekstu pojawiła się w 1778 r., gdzie „całe powietrze” stało się „bardziej zdrową i czystszą częścią powietrza” lub „wyjątkowo godną podziwu częścią powietrza”, a niektóre błędy zostały poprawione. W zmienionym tekście na temat kalcynacji metali, opublikowanym również w 1778 r., Lavoisier mówi, że „nie całe powietrze atmosferyczne jest w stanie respirabilnym; tylko ta zdrowa część, która podczas kalcynacji łączy się z metalami, a pozostaje rodzaj moffete (stęchlizna - język francuski), niezdolny do podtrzymania oddychania zwierząt lub palenia ciał”.
W 1776 roku Lavoisier rozpuszcza rtęć w kwasie azotowym(V), zbiera tlenek azotu(II), odparowuje roztwór i ogrzewa azotan(V) rtęci(II), który przekształca się w czerwony osad. Po podgrzaniu tego osadu odzyskał pierwotną masę użytej rtęci i „czystego powietrza” lub „prawdziwego powietrza”, które w powietrzu atmosferycznym miesza się z trzy- lub czterokrotnie większą objętością „szkodliwego powietrza” (air nuisible), które nie podtrzymuje spalania i nie nadaje się do oddychania. Odnosi się do „czystego powietrza” jako do „powietrza, które otrzymałem z wapna lub osadu rtęci, a przez Pana Pristleya uzyskanego z dużej liczby substancji przez potraktowanie ich duchem saletry [kwas azotowy(V)]. Powinien był zapisać, że J. Priestley sam powiedział mu o tym w październiku 1774 r., że uzyskał to powietrze przez ogrzewanie czerwonego osadu (tlenku rtęci(II)). Takie same doświadczenia wykonywali inni, o których Lavoisier nie wspomina w swoich pismach do Akademii. Przykładowo, Pierre Bayen, w lutym 1775 r., stwierdził, że czerwony osad stracił 1/15 swojej masy po podgrzaniu przekształcając się w rtęć bez dodawania materii zawierającej flogiston, tak samo jak wapno „pozwala ujść wystarczająco dużej ilości elastycznego płynu, dzięki któremu zawdzięcza swój stan”.
W eksperymencie z rtęcią Lavoisier rozłożył kwas azotowy(V) na powietrze saletrzane (tlenek azotu(V)) i czyste powietrze (tlen) i przez zmieszanie około 2 objętości. powietrza saletrzanego z 1 obj. czystego powietrza nad wodą, myślał, że powstał kwas azotowy(V). Nie znał wtedy składu powietrza saletrzanego, ale wynik ten dałby NO2 jako wzór bezwodnika kwasowego. H. Cavendish (1785) analizując tę reakcję wyliczył NO2,33, a poprawną wzór N2O5 określił dopiero w 1814 roku J. Berzelius.
Lavoisier potwierdził swoje poglądy na temat składu atmosfery słynnym eksperymentem opisanym w notatce przedstawionej w roku 1777, tym samym gdy opublikowano pracę C. Scheele’go, i wydrukowanej w 1780 r. W swoim eksperymencie wykorzystać rtęć umieszczoną w dużym szklanym naczyniu (retorcie), które następnie podgrzewał nad piecem. Z retorty wystawała długa rurka, wyprowadzona do innego naczynia, wypełnionego powietrzem i zanurzonego do góry dnem w wanience wypełnionej rtęcią. Kluczowym elementem tak zaprojektowanego doświadczenia była izolacja gazów obecnych w drugim naczyniu i w retorcie od gazów w środowisku zewnętrznym. Piec, na którym stoi retorta z rtęcią jest ogrzewany przez kolejne dwanaście dni. Po pierwszym dniu eksperymentu Lavoisier nie dostrzega nic szczególnego. Zgodnie z przewidywaniem rtęć w retorcie pod wpływem temperatury z pieca delikatnie paruje, tym samym jej opary trafiają do drugiego naczynia. Drugiego dnia na tafli rtęci w wypełniającej wanienkę pod odwróconym drugim naczyniem pojawiły się drobne czerwone plamki, których liczba i wielkość wzrastała w ciągu kolejnych pięciu dni. Powstające „znikąd” czerwone plamki były oznaką, że doszło do jakiejś przemiany chemicznej. W istocie plamki te były tlenkiem rtęci(II), za pomocą którego wcześniej J. Priestley (w reakcji odwrotnej) otrzymał ów „nowy rodzaj powietrza”. Dla Lavoisiera i współczesnych mu uczonych nie było jasne, czy takie czerwone plamki, które pojawiają się nad taflą rtęci, powstają na skutek transformacji samej rtęci, czy tworzą się z nicości, a rtęć i ciepło są tylko swoistym katalizatorem w tym akcie stworzenia.
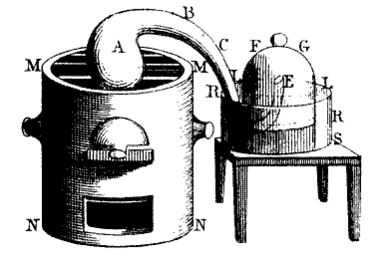 Rysunek M. Lavoisier z 1780 roku zamieszczony w Traité Élémentaire de ChimiePo dwunastu dniach prażenia francuski chemik oziębił całą aparaturę (gazy wewnątrz nadal były izolowane) i zaobserwował, że pod odwróconym naczyniem rtęć została wessana do góry o jedną piątą jego wysokości, co było równoważne z tym, że jedna piąta gazu w tym naczyniu zniknęła. Lavoisier wykonał podstawową analizę gazu, który pozostał w naczyniu. Okazało się, że gaz ten nie podtrzymuje palenia (w przeciwieństwie do powietrza atmosferycznego), dlatego Lavoisier nazwał go azotem, od greckiego azotikós – niepodtrzymujący życia, nieżywy. Następnie odważył 45 granów (czyli ok. 2,92 gramów) czerwonego proszku (otrzymanego w pierwszym eksperymencie) i ogrzewał w małej retorcie połączonej z odbieralnikiem i urządzeniem do zbierania gazu. Tym razem eksperyment trwał o wiele krócej, ponieważ już po kilku minutach czerwony proszek zniknął, w odbieralniku skropliło się 41,5 granów rtęci, a w cylindrze zebrało się 7-8 cali sześciennych gazu. W przeciwieństwie do wcześniej otrzymanego azotu ten gaz był przydatny do oddychania i dobrze podtrzymywał proces palenia. W dalszych eksperymentach Lavoisier wysnuwa również hipotezę, że jest to składnik obecny we wszystkich kwasach.
Rysunek M. Lavoisier z 1780 roku zamieszczony w Traité Élémentaire de ChimiePo dwunastu dniach prażenia francuski chemik oziębił całą aparaturę (gazy wewnątrz nadal były izolowane) i zaobserwował, że pod odwróconym naczyniem rtęć została wessana do góry o jedną piątą jego wysokości, co było równoważne z tym, że jedna piąta gazu w tym naczyniu zniknęła. Lavoisier wykonał podstawową analizę gazu, który pozostał w naczyniu. Okazało się, że gaz ten nie podtrzymuje palenia (w przeciwieństwie do powietrza atmosferycznego), dlatego Lavoisier nazwał go azotem, od greckiego azotikós – niepodtrzymujący życia, nieżywy. Następnie odważył 45 granów (czyli ok. 2,92 gramów) czerwonego proszku (otrzymanego w pierwszym eksperymencie) i ogrzewał w małej retorcie połączonej z odbieralnikiem i urządzeniem do zbierania gazu. Tym razem eksperyment trwał o wiele krócej, ponieważ już po kilku minutach czerwony proszek zniknął, w odbieralniku skropliło się 41,5 granów rtęci, a w cylindrze zebrało się 7-8 cali sześciennych gazu. W przeciwieństwie do wcześniej otrzymanego azotu ten gaz był przydatny do oddychania i dobrze podtrzymywał proces palenia. W dalszych eksperymentach Lavoisier wysnuwa również hipotezę, że jest to składnik obecny we wszystkich kwasach.
Lavoisier, opisując tlen, mówi o „tym powietrzu, które pan Priestley, pan Scheele i ja odkryliśmy mniej więcej w tym samym czasie”, ale Priestley powiedział Lavoisierowi o swoim eksperymencie polegającym na uzyskaniu gazu przez ogrzewanie czerwonego osadu, jednocześnie przyznając, że praca C. Scheele’go powstała niezależna od jego własnej. Lavoisier nie jest odkrywcą tlenu. Chociaż Lavoisier nie odkrył tlenu, z pewnością jako pierwszy zrozumiał konsekwencje jego odkrycia, uświadomił sobie jego prawdziwą naturę jako pierwiastka oraz dzięki pomysłowym eksperymentom ilościowym w celu ustalenia prawdziwej chemii spalania i kalcynacji metali, które były antycypowane przez R. Hooke’a i J. Mayowa, całkowicie zrewolucjonizował chemię - Berthelot pisze o jego pracy jako „La révolution chimique” - a Traite de Chimie Lavoisiera brzmi jak stare wydanie nowoczesnego podręcznika.
Teoria spalania Lavoisiera
W 1777 r. (Opublikowany w 1780 r.) Lavoisier stwierdził, że 1 część fosforu spalana w powietrzu pochłania 3 części powietrza, pozostawiając około czterech piątych lub pięć szóstych mofette atmosphérique, która po zmieszaniu z „deflogistonowanym lub doskonałym do oddychania powietrzem”, w celu uzupełnienia pierwotnej objętości, daje gaz o wszystkich właściwościach powietrza atmosferycznego. Doszedł do wniosku, że jedna czwarta objętości powietrza łączy się z fosforem, tworząc „stały kwas fosforowy (tj. P2O5 „kwasy” Lavoisiera zawsze są bezwodnikami). Siarka podczas spalania powoduje zmniejszenie objętości powietrza i powstaje stężony kwas witriolowy, o masie dwa lub trzy razy większej niż spalona siarka. (Ten błąd powtarza się w Traite de Chimie, 1789, s. 66.) Lavoisier uznał, że kwasy fosforowy(V) i siarkowy(VI) w ponad połowie składają się z powietrza doskonale nadającego się do oddychania. W tym samym roku ustalił skład kwasu siarkowego(VI), ogrzewając go z rtęcią, do momentu rozpoczęcia wydzielania dwutlenku siarki, a następnie prażąc otrzymaną sól (siarczan(VI) rtęci(II)), do rozkładu się na rtęć, dwutlenek siarki i tlen. Doszedł do wniosku, że „lotny kwas siarkowy jest kwasem witriolowym częściowo pozbawionym tlenu”.
5 sierpnia 1777 roku zaprezentował swoją teorię spalania ujmując ją w punkty:
- W każdym spalaniu następuje uwolnienie materii ognia lub światła.
- Ciało może palić się tylko w czystym powietrzu [gazowy tlen].
- Występuje „zniszczenie lub rozkład czystego powietrza”, a wzrost masy spalonego ciała jest dokładnie równy ciężarowi powietrza „zniszczonego lub rozłożonego”.
- Spalone ciało zmienia się w kwas przez dodanie substancji, która zwiększa jego wagę.
- Czyste powietrze jest związkiem materii ognia lub światła z podstawową materią. Podczas spalania płonące z ciała usuwana jest ta podstawowa materia, która jest silniej związana niż materia ciepła, a uwolniona materia ciepła pojawia się jako płomień, ciepło i światło.
Lavoisier mówi, że teoria flogistonu wyjaśnia zjawisko „w bardzo pomysłowy sposób”, ale lokalizuje materię ognia (flogiston) w materiale palnym, podczas gdy on zaproponował alternatywną hipotezę, że jest ona zawarta w czystym powietrzu.
Lavoisier udowodnił, w eksperymencie opublikowanym w 1786 r, że materia ciepła jest nieważka. Fosfor spalił się w powietrzu w zamkniętej kolbie, bez wyraźnej zmiany masy. Punkt (5) stanowi rozszerzenie teorii utajonego ciepła J. Blacka, która zakłada, że lód zamienia się w wodę, a wodę w parę, przez chemiczne połączenie z materią ciepła. W 1787 r. Guyton de Morveau nazwał nieprzenikalną materię ciepła „calorique” (kaloria). Kalcynacja, stwierdził Lavoisier, jest tylko powolnym spalaniem, ale zamiast kwasu powstaje wapno, związek metalu na bazie czystego powietrza.
W 1782 r. Lavoisier pisze, że N. Condorcet zaproponował nazwę „powietrze witalne” dla czystego powietrza, ale w notatce przesłanej do Akademii w 1777 r., przedstawionej członkom w 1779 r. i opublikowanej w 1781 r., zatytułowanej „Considérations Générales sur la Nature des Acides”, nazwał zasadę czystego powietrza „zasadą zakwaszającą” lub „zasadą oksygenową” (Principe oxigine), którą później zmienił na „oxygène”, wywodząc nazwę z greckiego οξύs (kwas) i geinomai (tworzyć, produkować)”; czyste powietrze zostało nazwane „gazem tlenowym” (gaz oxygène). Słowo „gas” była w użyciu od czasów van Helmeta, a we Francji stosował je Pierre Macquer; Lavoisier zmienił go na „gaz”.
Fosforowy, siarkowy, azotowy i prawdopodobnie wszystkie kwasy składają się z różnych zasad połączonych z zasadą tlenu. W eksperymencie ilościowym cukier utlenia się przez gotowanie z kwasem azotowym, wydziela się powietrze azotowe (NO) i „kwas kredowy” (acide crayeux aériforme, tj. dwutlenek węgla) i powstaje kwas szczawiowy, który „tworzy się w wyniku połączenia cukru z około jedną trzecią wagi zasady kwasowej”. Skład „kwasu kredowego” został oznaczony przez spalanie węgla drzewnego w tlenie nad rtęcią. Po ujęciu wagi powstającej wody (której składu nie znał aż do 1784 r.), Lavoisier stwierdził, że jedna część „kwasu kredowego” zawiera 0,234503 węgla (substance charbonneuse) i 0,765497 zasady tlenowej (Lavoisier zawsze używa nadmiaru miejsc po przecinku). Później przyjął wartości 72% i 28%, przy czym prawidłowe liczby to 72,7% i 27,3%, i jest to jeden z niewielu dobrych wyników ilościowych, które uzyskał. W tym pismie do Akaademii nazywa kwas kredowy „kwasem węglanym” (acide charbonneux), który został zmieniony w 1787 r. na „kwas węglowy” (acide carbonique).
Lavoisier i Laplace w 1783 r. wykorzystali kalorymetr do pomiaru ciepła właściwego i ciepła wydzielanego podczas spalania i oddychania. Prace te położyły podwaliny pod termochemię, zarówno po stronie eksperymentalnej, jak i teoretycznej, ponieważ autorzy dowiedli, że do rozłożenia związku potrzeba tyle samo ciepła, ile uwalnia się podczas tworzenia z pierwiastków. Piszą, że „oddychanie jest spalaniem, zachodzącym bardzo powoli, ale poza tym identycznym ze spalaniem węgla drzewnego; proces ten zachodzi we wnętrzu płuc” i „ciepło wytworzone w tym spalaniu jest przekazywane krwi, która przechodzi przez płuca i rozprzestrzenia się w organizmie zwierzęcym.”
Eksperymenty związane z oddychaniem
 Rysunek M. Lavoisier przedstawiający eksperymenty nad oddychaniem.J. Mayow, C. Scheele, J. Priestley i A. Lavoisier byli świadomi podobieństwa między spalaniem a oddychaniem. Lavoisier uważał, że gaz tlenowy wdychany do płuc utlenia zawierające węgiel substancje znajdujące się we krwi, wytwarzając wydychany dwutlenek węgla, a ciepło zwierząt jest wynikiem chemicznego procesu utleniania. W notatkach napisanych wspólnie z Armandem Seguin (1789; wydrukowany w 1793r.) Lavoisier przedstawia eksperymenty związane z oddychaniem, w których mierzono zużycie tlenu oraz wytwarzaną wodę i dwutlenek węgla. Lavoisier uważał, że utlenianie, wraz z wytwarzaniem ciepła zwierzęcego, zachodzi w płucach, ale J. Mayow już wiedział, że proces ten zachodzi w mięśniach. Lavoisier i Seguin twierdzą, że utlenianie węgla i wodoru dostarczanego przez żywność w celu wytworzenia ciepła odbywa się w pęcherzykach płuc, w których „humor” złożony z węgla i wodoru jest wydzielany z krwi. Jean-Henry Hassenfratz twierdzi, że J. L. Lagrange przypuszczał, że utlenianie zachodzi „nie tylko w płucach, ale we wszystkich częściach ciała, w których krąży krew”, ale pogląd ten nie został przyjęty, dopóki Gustav Magnus w 1837 r. nie wykazał, że zarówno krew tętnicza, jak i żylna wydzielały tlen i dwutlenek węgla w próżni.
Rysunek M. Lavoisier przedstawiający eksperymenty nad oddychaniem.J. Mayow, C. Scheele, J. Priestley i A. Lavoisier byli świadomi podobieństwa między spalaniem a oddychaniem. Lavoisier uważał, że gaz tlenowy wdychany do płuc utlenia zawierające węgiel substancje znajdujące się we krwi, wytwarzając wydychany dwutlenek węgla, a ciepło zwierząt jest wynikiem chemicznego procesu utleniania. W notatkach napisanych wspólnie z Armandem Seguin (1789; wydrukowany w 1793r.) Lavoisier przedstawia eksperymenty związane z oddychaniem, w których mierzono zużycie tlenu oraz wytwarzaną wodę i dwutlenek węgla. Lavoisier uważał, że utlenianie, wraz z wytwarzaniem ciepła zwierzęcego, zachodzi w płucach, ale J. Mayow już wiedział, że proces ten zachodzi w mięśniach. Lavoisier i Seguin twierdzą, że utlenianie węgla i wodoru dostarczanego przez żywność w celu wytworzenia ciepła odbywa się w pęcherzykach płuc, w których „humor” złożony z węgla i wodoru jest wydzielany z krwi. Jean-Henry Hassenfratz twierdzi, że J. L. Lagrange przypuszczał, że utlenianie zachodzi „nie tylko w płucach, ale we wszystkich częściach ciała, w których krąży krew”, ale pogląd ten nie został przyjęty, dopóki Gustav Magnus w 1837 r. nie wykazał, że zarówno krew tętnicza, jak i żylna wydzielały tlen i dwutlenek węgla w próżni.
Pierwiastki i nomenklatura chemiczna
 Wykaz pierwiastków zamieszczony na 192 stronie Traité Élémentaire de Chimie A. LavoisieraDefinicja „pierwiastka lub zasady” autorstwa Lavoisiera jako „ostatniego punktu, do którego analiza może dojść”, jest w istocie definicją R. Boyle'a: jest definicją otwartą ze względu na to, że „ponieważ dotychczas nie odkryliśmy sposobów ich rozdzielenia, to uważamy je za proste substancje, i nigdy nie powinniśmy przypuszczać, że są one złożone dopóki eksperyment i obserwacja nie udowodnią, że są takie”. W jego zestawie pierwiastków, który został zamieszczony na 192 stronie Traité Élémentaire de Chimie, godne uwagi jest pominięcie alkaliów: analogicznie do rozkładu amoniaku przez Bertholleta (1785), myślał, że mogą one później zostać uznane za związki chemiczne. Jednym z pierwszych chemików, którzy przyjęli poglądy Lavoisiera, był prawdopodobnie J. Black, który nauczał ich już przed 1784 rokiem. W 1785 roku C. L. Berthollet przyjął nową teorię, a następnie Guyton de Morveau w 1786 roku i A. Fourcroy w latach 1786-7. Lavoisier i ci trzej chemicy opublikowali w 1787 r. Méthode de Nomenclature Chimique, w której zmieniono nazwy substancji chemicznych, aby dostosować je do nowej teorii. Pomogło to w jej szerokim przyjęciu, podobnie jak Traité Élémentaire de Chimie Lavoisiera z roku 1789. Antoine François de Fourcroy (1755-1809) był gorliwym propagatorem nowej teorii w swoich wykładach i książkach, a jego obszerne dzieło Systéme des connaissances chimiques (11 tomów, 1801 r.) było podręcznikiem oferującym szeroko ujętą wiedzę wyrażoną w bardzo przystępnej formie. Chemicy spoza Francji poszli w ich ślady i tylko kilku starszych konserwatystów, takich jak J. Priestley w Anglii, P. Macquer we Francji i J. Ch. Wiegleb w Niemczech odmówili przyjęcia nowych teorii. Niemieccy chemicy byli równie gotowi do przyjęcia nowych teorii, pierwszym tekstem w języku niemieckim opartym na poglądach Lavoisiera było dzieło Ch. Girtannera, Anfangsgründe der antiphlogistischen wydane w roku 1792.
Wykaz pierwiastków zamieszczony na 192 stronie Traité Élémentaire de Chimie A. LavoisieraDefinicja „pierwiastka lub zasady” autorstwa Lavoisiera jako „ostatniego punktu, do którego analiza może dojść”, jest w istocie definicją R. Boyle'a: jest definicją otwartą ze względu na to, że „ponieważ dotychczas nie odkryliśmy sposobów ich rozdzielenia, to uważamy je za proste substancje, i nigdy nie powinniśmy przypuszczać, że są one złożone dopóki eksperyment i obserwacja nie udowodnią, że są takie”. W jego zestawie pierwiastków, który został zamieszczony na 192 stronie Traité Élémentaire de Chimie, godne uwagi jest pominięcie alkaliów: analogicznie do rozkładu amoniaku przez Bertholleta (1785), myślał, że mogą one później zostać uznane za związki chemiczne. Jednym z pierwszych chemików, którzy przyjęli poglądy Lavoisiera, był prawdopodobnie J. Black, który nauczał ich już przed 1784 rokiem. W 1785 roku C. L. Berthollet przyjął nową teorię, a następnie Guyton de Morveau w 1786 roku i A. Fourcroy w latach 1786-7. Lavoisier i ci trzej chemicy opublikowali w 1787 r. Méthode de Nomenclature Chimique, w której zmieniono nazwy substancji chemicznych, aby dostosować je do nowej teorii. Pomogło to w jej szerokim przyjęciu, podobnie jak Traité Élémentaire de Chimie Lavoisiera z roku 1789. Antoine François de Fourcroy (1755-1809) był gorliwym propagatorem nowej teorii w swoich wykładach i książkach, a jego obszerne dzieło Systéme des connaissances chimiques (11 tomów, 1801 r.) było podręcznikiem oferującym szeroko ujętą wiedzę wyrażoną w bardzo przystępnej formie. Chemicy spoza Francji poszli w ich ślady i tylko kilku starszych konserwatystów, takich jak J. Priestley w Anglii, P. Macquer we Francji i J. Ch. Wiegleb w Niemczech odmówili przyjęcia nowych teorii. Niemieccy chemicy byli równie gotowi do przyjęcia nowych teorii, pierwszym tekstem w języku niemieckim opartym na poglądach Lavoisiera było dzieło Ch. Girtannera, Anfangsgründe der antiphlogistischen wydane w roku 1792.
Zanim nowa teoria Lavoisiera mogła zostać zaakceptowana przez innych chemików, trzeba było usunąć poważną trudność. Metal, taki jak cyna lub cynk, rozpuszcza się w kwasie, dając palne powietrze, a po odparowaniu roztworu pozostaje sól, która po silnym podgrzaniu rozdziela się z kwasem i pozostawia wapno metalu. Ta sama sól powstaje, gdy wapno rozpuszcza się w kwasie, ale nie powstaje wówczas palne powietrze. Skąd zatem pochodzi palne powietrze w pierwszym eksperymencie? To było łatwe pytanie dla wyznawców teorii flogistonowej. Palne powietrze to flogiston; metal natomiast to wapno + flogiston; a sól to wapno + kwas. W pierwszym eksperymencie:
(wapno + φ) + kwas → (wapno + kwas) + φ
Trudność była poważna i Lavoisier nie był w stanie wyjaśnić tego problemu. Pierwszego impulsu do wyjaśnienia problemu dostarczyły badania H. Cavendisha nad powstawaniem wody z palnego powietrza i powietrza deflogistonownego. W 1781 r. J. Priestley dokonał wybuchowej reakcji mieszaniny palnego i deflogistonowanego powietrza i zauważył pojawienie się rosy na ścianach naczynia. Priestley stwierdził, że ten „przypadkowy eksperyment” potwierdził opinię Johna Warltire'a, że „zwykłe powietrze osadza wilgoć, gdy jest flogistonowane”. Warltire wykonał swój eksperyment zapalając mieszaninę gazów iskrą elektryczną w zamkniętej miedzianej kuli, i stwierdził niewielki ubytek masy, który przypisał ucieczce ciepła. Priestley przekazał wyniki tych eksperymentów Jamesowi Wattowi i H. Cavendishowi, którzy kontynuowali je za zgodą Priestleya.
W marcu 1782 r. Priestley zbadał reakcje wapna (tlenki) metali po ich podgrzaniu w palnym powietrzu (wodór) odkrytym przez Cavendisha w 1766 r. Gaz ten zebrano, nad wodą lub rtęcią, w naczyniu, a wapno wprowadzano na pionowej łyżce do spalań i ogrzewano promieniami słonecznymi skupione w soczewce. Używając czerwonej minii ołowianej, uzyskał metaliczny ołów i udało mu się sprawić, że wapno pochłonęło praktycznie całe palne powietrze. Ponieważ ołów = wapno + flogiston wydaje się, że palne powietrze jest tym samym co flogiston; pogląd ten wyrażał również H. Cavendish w 1766 r. i R. Kirwan w roku 1782. Priestley był zdania, że metal powinien ważyć więcej niż wapno, ale ponieważ nigdy tak nie było stwierdził, że utrata masy ciała była spowodowana sublimacją pewnych porcji wapna. Pisze:
„Widząc, że metal rzeczywiście ulega odtworzeniu, i to w znacznej ilości, w tym samym czasie, gdy objętość powietrza ulega zmniejszeniu, nie mogłem wątpić, ale że wapno rzeczywiście pochłania coś z powietrza; a ze względu na jego wpływ na przekształcanie wapna w metal, nie może być niczym innym niż tym, czemu chemicy jednogłośnie nadali nazwę o phlogiston.”
Priestley doszedł do wniosku, że flogiston występuje w stanie połączonym w metalach, podobnie jak utrwalone powietrze jest obecne w kredzie, przy czym obydwie te substancje mogą być w równym stopniu uwalniane przez kwasy. Powtórzył eksperyment z wapnem rtęci, przy czym palne powietrze było zebrane nad rtęcią, i zauważył, że „mimo iż palne powietrze było wcześniej dobrze osuszone stałym amoniakiem (chlorek wapnia), wytworzyła się woda w „wystarczającej ilości”. Podejrzewał, że woda była zawarta w gazie i jest osadzana, gdy „tego rodzaju powietrze ulega rozkładowi.” Stwierdził również, że powietrze alkaliczne (gazowy amoniak) redukowało wapno ołowiu, ale pozostawiało znaczne ilości flogistonowego powietrza (azotu).