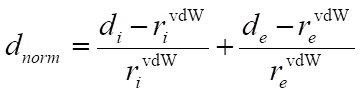Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
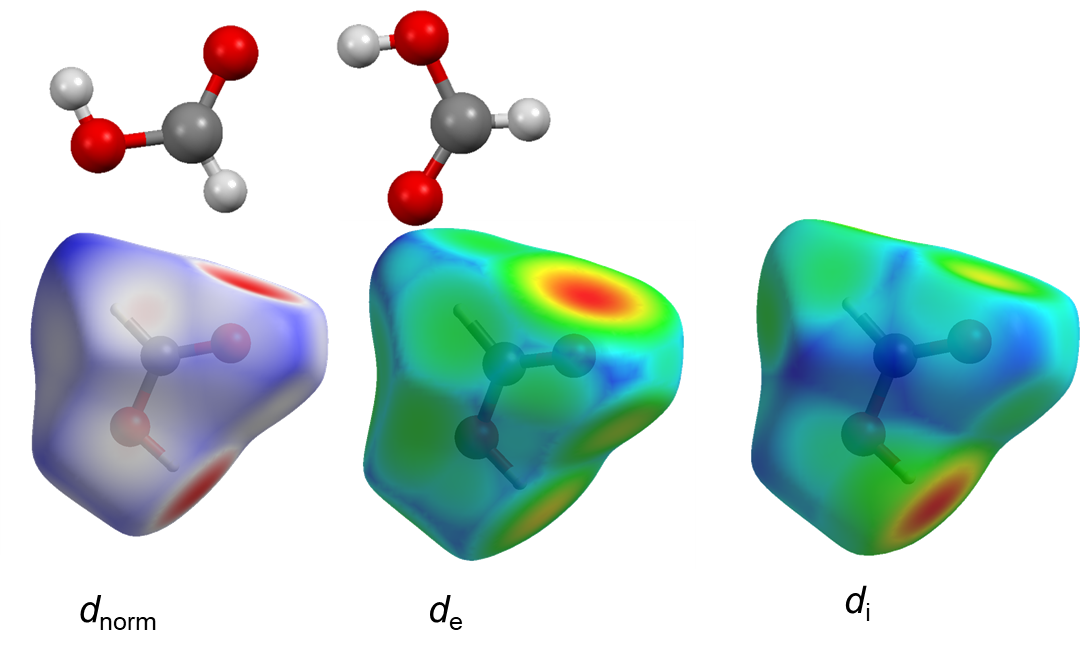
 Powierzchnia Hirshfelda
Powierzchnia Hirshfelda
Powierzchnia Hirshfelda dla cząsteczki w krysztale jest konstruowana przez podzielenie przestrzeni kryształu na regiony, w których rozkład gęstości ładunków opisujących sumę udziałów sferycznych atomów dla cząsteczki (promolecule) przeważa nad sumą gęstości elektronowej kryształu ( procrystal). Zgodnie z modelem opracowanym przez Hirshfelda określamy wagi poszczególnych udziałów według wzorów:
![]()

Gdzie ρA(r) - sferyczny rozkład gęstości elektronowej na atomie A; promolecule, procrystal - oznaczają odpowiednio sumy gęstości należące do cząsteczek i do całego kryształu. Według tego powierzchnia Hirshfelda jest to obszar w którym w(r) ≥ 0,5.  W tym obszarze oddziaływania wewnątrz– i międzycząsteczkowe przeważają nad udziałem otoczenia kryształu.
W tym obszarze oddziaływania wewnątrz– i międzycząsteczkowe przeważają nad udziałem otoczenia kryształu.
Definiuje się dwie odległości:
- di - odległość od powierzchni do najbliższego atomu wewnątrz obszaru zamkniętego powierzchnią
- de - odległość od powierzchni do najbliższego atomu na zewnątrz powierzchni
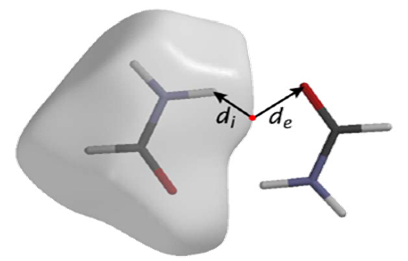
Ponadto:
- wskaźnik kształtu (shape index) S - mierzący „krzywiznę” powierzchni

- stopień krzywizny (curvedness) C – wartości od -1 powierzchnia wklęsła, 0 – płaska; +1 wypukła

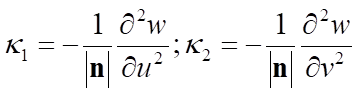
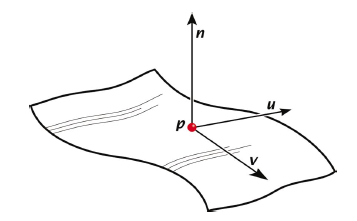
- Normalized contact distance dnorm- zależne od di, de oraz promieni van derWalsa poszczególnych atomów