 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Rola termodynamiki w chemii nieorganicznej
Rola termodynamiki w chemii nieorganicznej
Dane termodynamiczne pełnią w chemii istotną rolę przy rozpatrywaniu trwałości chemicznej związków i przy rozpatrywaniu przebiegu reakcji chemicznych. Cykl Borna-Habera pojawił się już przy omawianiu wiązań jonowych. Generalnie cykle termodynamiczne stanowią sposób przedstawiania lub interpretowania danych doświadczalnych. Takie ujęcie jest bardzo przydatne gdyż rozważanie zmian zachodzących pomiędzy pierwiastkami rozbitych na poszczególne etapy, co umożliwia zastosowanie termodynamiki, jest prostsze niż rozpatrywanie całkowitych energii reakcji. Omówienie wybranych zagadnień z historii termodynamiki można znaleźć w pliku pdf.
Stała równowagi reakcji chemicznej jest związana z całkowitą zmianą energii swobodnej zachodzącej reakcji. Gdy reakcja zachodzi w układzie o stałym ciśnieniu posługujemy się entalpią swobodną G, a w przypadku stałej objętości energią swobodną F. Przy stałym ciśnieniu zależność pomiędzy stałą równowagi Kp a entalpią swobodną G° wyraża równanie:
ΔG°= –RTlnKp
Zmianę entalpi swobodnej możemy związać ze standardowymi entalpią i entropią w następujący sposób:
ΔG°= ΔH° – TΔS°
Dane odnoszące się do entalpii standardowej są łatwiej dostępne od odnoszących się do entropii. Jest to jeden z powodów dla których rozważania termodynamiczne w chemii nieorganicznej często opiera się na entalpii. Dodatkowo przyjmuje się założeni, że zmiany entalpii i entropii standardowych są niezależne od temperatury, co nie jest prawdą. Innym przybliżeniem jest przyjęcie dominującej roli zmian entalpii przy wyznaczaniu ΔG°.
Standardowe ciepło tworzenia danego związku chemicznego jest zmianą entalpii układu jaka zachodzi podczas tworzenia jednego mola związku z pierwiastków w ich stanach standardowych w temperaturze pomiaru. Dodatnie ciepło tworzenia ΔH°tw oznacza, że związek jest nietrwały gdyż rozkłada się na pierwiastki składowe. Z punktu widzenia termodynamiki jest to prawdą, ale istnieje szereg związków, których ciepła tworzenia są dodatnie a mimo to związki te można otrzymać i nie obserwuje się ich rozkładu. Związki takie wykazują trwałość kinetyczna i pomimo dodatnich ciepeł tworzenia ich rozkład następuje nieskończenie wolno. Przykładem są wszystkie związki organiczne, które pod względem termodynamiki są niestabilne i powinny ulegać na powietrzu rozkładowi. Nie dzieje się tak ze względu na ich trwałość kinetyczną. Z drugiej strony ujemna wartość ciepła tworzenia nie gwarantuje, że związek będzie trwały. Przykładowo wartość entalpii standardowej tworzenia MnCl3 wynosi –460 ± 20 kJ/mol, a MnCl2 –482 ± 4 kJ/mol to MnCl3 jest trwały jedynie w atmosferze chloru. W innych warunkach ulega rozkładowi zgodnie z równaniem reakcji MnCl3 → MnCl2 + 1/2Cl2. Rozważając trwałość termodynamiczną musimy znać najbardziej prawdopodobny produkt rozkładu lub najbardziej prawdopodobną reakcję w której zachodzi rozkład danego związku chemicznego.
Wielkości termodynamiczne takie jak entalpia w przypadku związków chemicznych są skorelowane z energią wiązania rozumiana zgodnie z teorią wiązań zlokalizowanych. Innymi słowy energia wiązania dla cząsteczki dwuatomowej odpowiada energii jaka jest potrzebna do jej dysocjacji. W cząsteczkach organicznych takich jak metan energia wiązania odpowiada 1/4 wielkości zmiany entalpii jaka zachodzi w reakcji syntezy jednego mola metanu z jednego mola zdysocjowanego na atomy gazowego węgla i czterech moli zdysocjowanego gazowego wodoru. Dla związków organicznych wartości ciepeł tworzenia można uzyskać przez proste zsumowanie odpowiednich energii wiązań. Ciepła tworzenia i spalania prostych węglowodorów i innych związków organicznych tworzących szeregi homologiczne zwiększają się liniowo wraz ze wzrostem ilości grup CH2. W przypadku związków nieorganicznych addytywność energii wiązań jest mniej zadowalająca. Zwłaszcza gdy następuje zmiana stopnia utlenienia, liczby koordynacji czy też w grę wchodzą wiązania wielokrotne. W związku z tym założenie o ścisłej addytywności w chemii nieorganicznej powinno być stosowane ostrożnie.
Cykle termodynamiczne
 Na podstawie znajomości ciepła tworzenia WCl6 oraz ciepeł atomizacji wolframu i chloru można obliczyć energię wiązania W–Cl.
Na podstawie znajomości ciepła tworzenia WCl6 oraz ciepeł atomizacji wolframu i chloru można obliczyć energię wiązania W–Cl.
Podobne rozważania można przeprowadzić dla reakcji:
WCl6 + 6CH3Li → W(CH3)6 + LiCl
Podstawiając wartości entalpii tworzenia metylolitu, chlorku litu i sześciochlorku wolframu uzyskujemy wartość ΔH° tworzenia W(CH3)6 równą +738,7 kJ/mol, a wartość energii wiązania W–C 159 kJ/mol. Duża dodatnia wartość entalpii tworzenia wskazuje na to, że związek ten jest nietrwały. Jednak jako produkt tej reakcji występuje szczególnie trwały chlorek litu i w tym układzie możliwe staje się utworzenie innego związku o mniejszej trwałości.
Zastosowanie modelu jonowego do opisu termodynamiki reakcji: MFs) + BF3(g) → MBF4(s), wymusza użycie wyrazów opisujących energię sieci (U) oraz ciepło asocjacji (A) pomiędzy F– i BF3. Odpowiedni cykl termodynamiczny dla tej reakcji jest następujący: 
Zmiana entalpii jest w tym przypadku dana wyrażeniem ΔH = A –U (MBF4) + U (MF). Energia sieci U(MF) jest zawsze większa niż U(MBF4) ponieważ jon fluorkowy jest znacznie mniejszy niż jon BF4–. Rekcja będzie zachodzić najłatwiej gdy jon metalu M będzie duży gdyż wtedy różnica U(MF) –U(MBF4) będzie najmniejsza. W takim wypadku oczekujemy, że CsBF4 będzie trwalszy niż LiBF4. Uogólniając można stwierdzić, że w ciele stałym duże aniony stabilizują duże kationy i odwrotnie.
Efekty entropowe
Jak do tej pory główny nacisk w rozważaniach termodynamicznych kładliśmy na entalpię. Natomiast istnieje szereg zjawisk, w których zmiany entropii odgrywają decydującą rolę. Przykładem mogą być defekty pojawiające się w strukturze krystalicznej. Ich występowanie może być związane z korzystnym wzrostem entropii. W takich wypadkach czynnik ΔS° będzie miał duże znaczenie zwłaszcza gdy wartość zmiany entalpii ΔH° będą miały wartość zbliżona do zera.
Pierwszym takim przypadkiem jest rozpuszczalność ciał stałych o budowie jonowej. Pomimo tego, że ciepła hydratacji gazowych jonów są zawsze ujemne to są one równoważone przez energię sieci. Wynika to z faktu, że podczas rozpuszczania zmianie ulega jedynie otoczenie poszczególnych jonów. W sieci krystalicznej ciała jonowego jony są otoczone jonami o przeciwnych znakach, a w rozpuszczalniku miejsce jonów zajmują cząsteczki polarnego rozpuszczalnika. W przypadku kationu energia elektrostatycznego oddziaływania z anionem w sieci krystalicznej, po rozpuszczeniu zmienia się na energię oddziaływania elektrostatycznego z ujemnym biegunem dipola rozpuszczalnika. Natomiast zysk entropii spowodowany zniszczeniem, uporządkowanej, sieci krystalicznej jest duży. Nie można zapominać o tym, że jeżeli uporządkowanie cząsteczek rozpuszczalnika wokół jonu w roztworze jest duże to entropia hydratacji jonu jest ujemna. Dzieje się tak w przypadku małych jonów lub obdarzonych znacznymi ładunkami. Z rozważań nad termodynamika rozpuszczania soli jonowych prowadzą do następującego wniosku. Ciała stałe zbudowane z małych przeciwnie naładowanych jonów (LiF) lub jonów o dużym ładunku (BaSO4) często wykazują słabą rozpuszczalność.
Należy pamiętać o tym, że sole uwodnione i bezwodne muszą być traktowane oddzielnie. W przypadku soli uwodnionych czynnik entropowy ma większe znaczenie niż czynnik związany z entalpią, niż ma to miejsce w przypadku soli bezwodnych. Ponieważ rozpuszczalność soli jonowych zależy od równowagi członów związanych z entropią i entalpia to oczywistym jest, że zmiana rozpuszczalnika wpływa na rozpuszczalność.
Drugą wielkością jaka wykazuje zależność od entropii jest stała równowagi związków koordynacyjnych. Można wyróżnić dwie stałe równowagi takich reakcji: stopniową stałą równowagi –Kn –odnoszącą się do reakcji:
Mln-1 + L → Mln
lub ogólną stałą trwałości βn, odnoszącą się do reakcji:
M + nL ↔ MLn
Wartość zmian entalpii dla tych reakcji są niewielkie natomiast istotną rolę odgrywa tutaj zmiana entropii. Gdy jony tworzące związek koordynacyjny mają duże ładunki, to znajdując się w roztworze powodują znaczne uporządkowanie cząsteczek rozpuszczalnika. Po utworzeniu związku 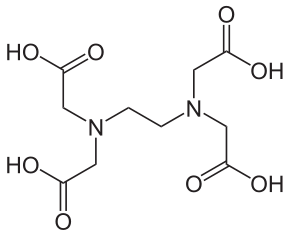 kwas etylenodiaminotetraoctowy (EDTA)kompleksowego całkowity ładunek związku odpowiada różnicy ładunków jonów swobodnych. Jednocześnie wielkość jonu kompleksowego jest większa niż wielkość składowych. Obydwa te czynniki powodują zmniejszenie uporządkowania cząsteczek rozpuszczalnika i wzrost entropii układu. Szczególnie widoczne jest to przy tworzeniu związków koordynacyjnych przez ligandy wielokleszczowe. W takim przypadku ligand zajmując więcej niż jedno miejsce koordynacji uwalnia większą liczbę cząsteczek rozpuszczalnika. Efekt chelatowy jest szczególnie widoczny w przypadku wielokleszczowych ligandów jonowych jak EDTA, gdyż łącząc się z metalem dodatkowo zwiększa zysk entropowy wywierany prze jego duży ujemny ładunek.
kwas etylenodiaminotetraoctowy (EDTA)kompleksowego całkowity ładunek związku odpowiada różnicy ładunków jonów swobodnych. Jednocześnie wielkość jonu kompleksowego jest większa niż wielkość składowych. Obydwa te czynniki powodują zmniejszenie uporządkowania cząsteczek rozpuszczalnika i wzrost entropii układu. Szczególnie widoczne jest to przy tworzeniu związków koordynacyjnych przez ligandy wielokleszczowe. W takim przypadku ligand zajmując więcej niż jedno miejsce koordynacji uwalnia większą liczbę cząsteczek rozpuszczalnika. Efekt chelatowy jest szczególnie widoczny w przypadku wielokleszczowych ligandów jonowych jak EDTA, gdyż łącząc się z metalem dodatkowo zwiększa zysk entropowy wywierany prze jego duży ujemny ładunek.
Na koniec należy jeszcze wspomnieć o reakcjach zachodzących w wysokich temperaturach. W takich warunkach w miarę wzrostu temperatury czynnik entropowy znacznie przewyższa czynnik ΔH. Szczególnie jest to widoczne gdy substratami reakcji są ciała stałe, a produktami gazy. W reakcji następuje wtedy wzrost ilości cząsteczek co prowadzi do wzrostu entropii.