 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
Układ okresowy pierwiastków
 Lavoisier_Traité_élémentaire_de_chimie_p192Pierwsze próby systematyzacji pierwiastków chemicznych można przypisać A. Lavoisierowi, który w 1789 roku w swoim traktacie „Traité élémentaire de chimie” zestawił listę substancji prostych obejmującą siedem pierwiastków jak tlen, azot, wodór, fosfor, rtęć, cynk i siarka. Dodatkowo Lavoisier zaliczył do substancji prostych (pojęcie pierwiastka jeszcze nie istniało) ciepło i światło, ale jednocześnie podzielił substancje na metale i niemetale.
Lavoisier_Traité_élémentaire_de_chimie_p192Pierwsze próby systematyzacji pierwiastków chemicznych można przypisać A. Lavoisierowi, który w 1789 roku w swoim traktacie „Traité élémentaire de chimie” zestawił listę substancji prostych obejmującą siedem pierwiastków jak tlen, azot, wodór, fosfor, rtęć, cynk i siarka. Dodatkowo Lavoisier zaliczył do substancji prostych (pojęcie pierwiastka jeszcze nie istniało) ciepło i światło, ale jednocześnie podzielił substancje na metale i niemetale.
Dopiero wiek dziewiętnasty, wraz z niespotykanym rozwojem badań naukowych, a w szczególności analizą chemiczną, przyniósł odkrycia wielu nowych substancji prostych powodując potrzebę ich uszeregowania. Jako pierwszy uszeregowania pierwiastków według pewnych reguł podjął się niemiecki chemik Johann Wolfgang Döbereiner. Czynnikiem, który skłonił go do podjęcia tej próby było odkrycie trzech halogenów chloru, bromu, jodu i stwierdzenie podobieństwa ich właściwości chemicznych. Döbereiner rozważania nad uszeregowaniem pierwiastków rozpoczął w roku 1817, zestawiając grupy składające się z trzech elementów posiadających podobne właściwości chemiczne. Poszczególne triady wyglądały następująco:
lit, fosfor, arsen; wapń, stront, bar; chlor, brom, jod; siarka, selen, tellur; węgiel, azot, tlen; żelazo, kobalt, nikiel.
Uwagę uczonego zwróciła zależność pomiędzy masami atomowymi tak ułożonych pierwiastków, co pozwoliło na sformułowanie prawa traid. Zgodnie z nim masa atomowa środkowego pierwiastka jest w przybliżeniu równa arytmetycznej średniej sumy mas atomowych pierwiastków pierwszego i trzeciego. Przybliżenie w niektórych przypadkach jest dość duże; przykładowo masa atomowa fosforu to w przybliżeniu 31, a średnia mas litu i arsenu wynosi 41. Dodatkowo triady Döbereinera nie wskazywały na periodyczność pierwiastków.
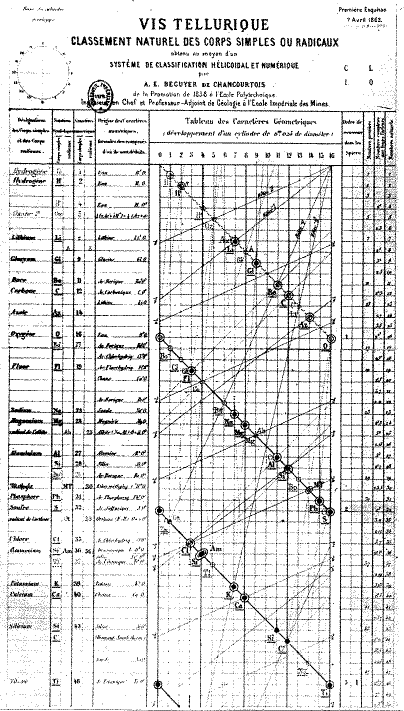 Śruba tellurometryczna De ChancourtoisPierwszym uczonym, który wskazał na periodyczną zmianę właściwości pierwiastków chemicznych był francuski geolog Alexandre-Emile Béguyer de Chancourtois. W roku 1863 stworzył on diagram, na którym pierwiastki zostały ułożone względem ich mas atomowych. Nazwy pierwiastków zostały spiralnie naniesione na bęben, którego średnica była tak dobrana, że łańcuch nazw tworzył pełen obrót spirali co osiem pierwiastków. Taki układ powodował, że patrząc wzdłuż linii prostopadłych do podstawy widziało się na powierzchni bębna pierwiastki o podobnych właściwościach. Swój diagram nazwał „vis tellurique” czyli śrubą tellurometryczną wywodząc nazwę od niedawno odkrytego pierwiastka telluru, który znalazł się na środku diagramu. Diagram de Chancourtoisa nie znalazł uznania w środowisku naukowym pozostając swoistą osobliwością.
Śruba tellurometryczna De ChancourtoisPierwszym uczonym, który wskazał na periodyczną zmianę właściwości pierwiastków chemicznych był francuski geolog Alexandre-Emile Béguyer de Chancourtois. W roku 1863 stworzył on diagram, na którym pierwiastki zostały ułożone względem ich mas atomowych. Nazwy pierwiastków zostały spiralnie naniesione na bęben, którego średnica była tak dobrana, że łańcuch nazw tworzył pełen obrót spirali co osiem pierwiastków. Taki układ powodował, że patrząc wzdłuż linii prostopadłych do podstawy widziało się na powierzchni bębna pierwiastki o podobnych właściwościach. Swój diagram nazwał „vis tellurique” czyli śrubą tellurometryczną wywodząc nazwę od niedawno odkrytego pierwiastka telluru, który znalazł się na środku diagramu. Diagram de Chancourtoisa nie znalazł uznania w środowisku naukowym pozostając swoistą osobliwością.
Rok później (1854) angielski chemik John Alexander Reina Newlands ułożył 62 znane pierwiastki w osiem grup, opierając się na ich właściwościach chemicznych. Zauważył on, że jeżeli ułożyć pierwiastki względem wzrastających mas atomowych to ich właściwości powtarzają się co osiem, analogicznie jak dźwięki w oktawie muzycznej. Jego prawo oktaw zostało opublikowane w Chemistry News wywołując pewne kontrowersje. W dniu 1 marca 1866 roku wygłosił wykład dla Królewskiego Towarzystwa Naukowego, który nie został opublikowany. Członkowie Towarzystwa stwierdzili, że takie „zagadnienia teoretyczne” mogą być kontrowersyjne i broniąc powagi naukowej nie zdecydowali się na publikację referatu Newlandsa. Odkryte przez angielskiego uczonego prawo okresowości znalazło swoje uzasadnienie dopiero w roku 1916 kiedy to Amerykanin Gilbert Newton Lewis sformułował swoją teorię wiązań walencyjnych, a trzy lata później, w 1919, Irving Langmuir teorię oktetu zastosował do wiązań chemicznych. Newlands został przez Królewskie Towarzystwo Naukowe uhonorowany złotym medalem pięć lat po ogłoszeniu przez Mendelejewa układu okresowego pierwiastków.
Dmitrij Iwanowicz Mendelejew zestawił wszystkie znane ówcześnie pierwiastki w kolejności wzrastających mas atomowych (pojęcie liczby atomowej jeszcze nie istniało) i zauważył, że właściwości pierwiastków powtarzają się okresowo. Forma tablicy jaką przyjęło to zestawienie była podobna do tej jaką posługujemy się dzisiaj. Istnieje legenda, że tworząc swój układ okresowy, Mendelejew posługiwał się zestawem kart z naniesionymi nazwami i właściwościami znanych pierwiastków, którymi grał w swoistego pasjansa. 6 marca 1869 roku zaprezentował ostateczną wersję układu okresowego na forum Rosyjskiego Towarzystwa Chemicznego wygłaszając wykład: „Zależność pomiędzy właściwościami a masa atomową pierwiastków”. W tym samym roku tablica Mendelejewa została opublikowana w naukowym czasopiśmie rosyjskim i przetłumaczona na niemiecki w Zeitschrift für die Chemische. 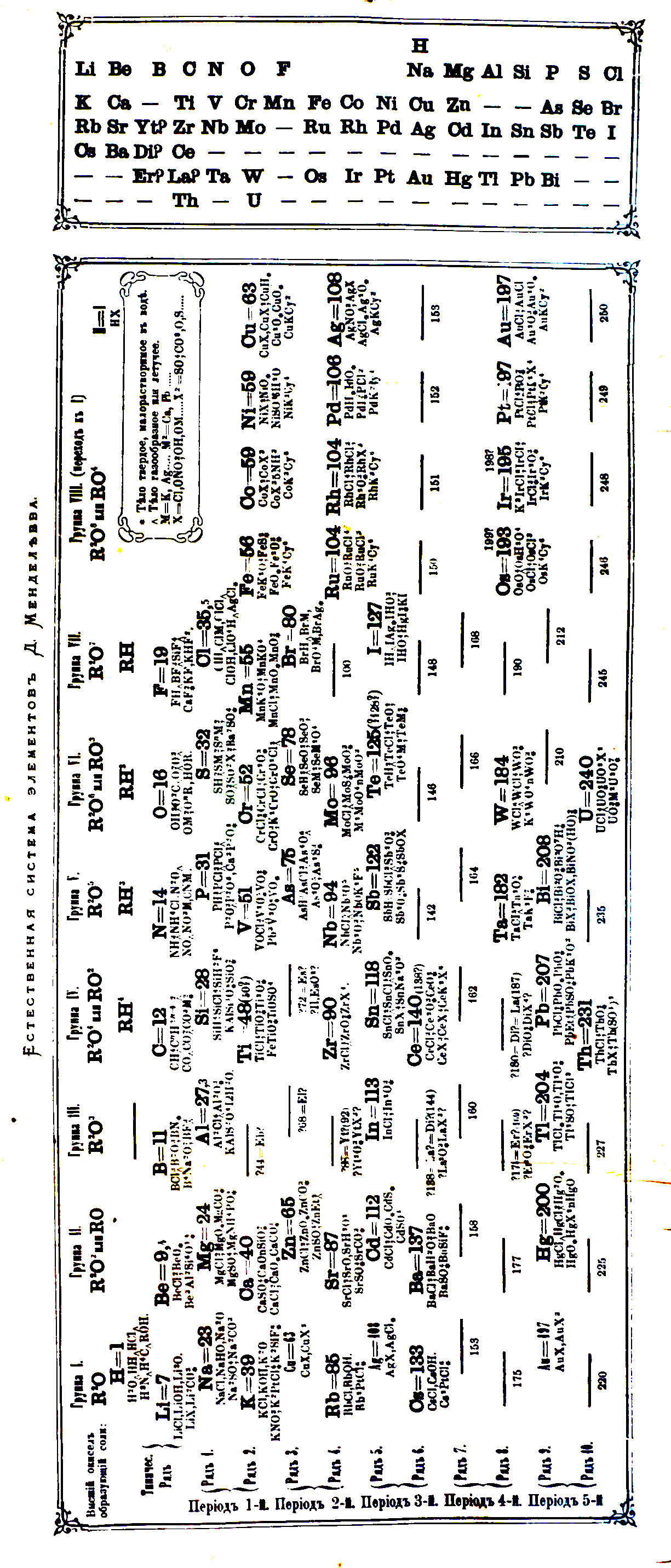 Dmitry Mendeleyev, Osnovy Khimii_1869-1871. Pierwszy układ okresowy
Dmitry Mendeleyev, Osnovy Khimii_1869-1871. Pierwszy układ okresowy
Główne tezy Mendelejewa sprowadzały się do kilku punktów. Jako pierwsze nasuwa się stwierdzenie periodyczności właściwości chemicznych pierwiastków ułożonych względem ich mas atomowych, a dodatkowo stwierdzenie, że pierwiastki o podobnych właściwościach posiadają zbliżone masy atomowe jak platyna, iryd czy osm, lub ich masy zwiększają się w sposób regularny, jak na przykład w szeregu potas, rubid, cez. Uporządkowanie pierwiastków lub grup pierwiastków ze względu na masę atomową odpowiada ich wartościowości. Najbardziej rozpowszechnione w przyrodzie pierwiastki mają małe masy atomowe. Wielkość masy atomowej określa charakter pierwiastka. Niezwykle istotne było następne stwierdzenie Mendelejewa, że musza istnieć nieodkryte jeszcze pierwiastki o masach atomowych pomiędzy 65 a 75 o podobnych właściwościach do glinu i krzemu. Uczony pozostawił miejsca w swoim układzie na nieodkryte pierwiastki nazywając je eka-krzem, eka-glin i eka-bor, które odkryte później zostały nazwane odpowiednio germanem, galem i skandem. Masy atomowe niektórych pierwiastków muszą być inne niż wyznaczone eksperymentalnie ze względu na ich położenie w układzie okresowym. Ta uwaga Mendelejewa odnosiła się do telluru, którego masę atomową wyznaczono błędnie. Mendelejew twierdził, że jego masa atomowa powinna zawierać się pomiędzy 123 a 126 i nie może wynosić 128. Rzeczywista masa atomowa tego pierwiastka wynosi 127,06.
W układzie Mendelejewa nie było gazów szlachetnych, gdyż nie były one jeszcze znane, a które, gdy zostały odkryte, zajęły dodaną przez Williama Ramsaya kolejną grupę co nie zburzyło struktury tabeli Mendelejewa. Problem sprawił najlżejszy z pierwiastków, wodór, który w układzie okresowym znalazł się w grupie litowców, ale Mendelejew rozpatrywał umieszczenie go albo w grupie halogenów lub oddzielnie pomiędzy borem a węglem.
Niezależnie od Mendelejewa nad opracowaniem układu pierwiastków pracował niemiecki chemik Julius Lothar Meyer, który w 1864 roku opublikował swoją tablicę pierwiastków. Układ Meyera zawierał tylko 28 elementów, które w pierwszej wersji były uszeregowane względem wartościowości pierwiastków. Układ Meyera nie pozwalał na przewidywanie istnienia pierwiastków i chociaż prace obydwu uczonych zbiegły się w czasie to dokonanie Mendelejewa znalazło uznanie. W roku 1864 została przedstawiona jeszcze jedna tablica pierwiastków chemicznych. Jej twórca był angielski chemik William Odling, którego tablica przedstawiała grupy pierwiastków uszeregowane w poziomie a nie w pionie jak u Mendelejewa. Odlingowi udało się zdobyć uznanie dla swojego osiągnięcia jednak cieniem na jego reputacji położyło się podejrzenie, że jako sekretarz Królewskiego Towarzystwa Naukowego zdyskredytował udział Newlandsa w powstaniu układu okresowego.
Mendelejew został w roku 1905 przyjęty w poczet Królewskiej Szwedzkiej Akademii Nauk, a rok później Komitet nominował go do nagrody Nobla w dziedzinie chemii. Komisja wniosek poparła, co z reguły jest równoznaczne z przyznaniem nagrody. Jednak członek Akademii, na posiedzeniu plenarnym wysunął kandydaturę Henriego Moissana, którego notabene był dobrym znajomym. Niespodziewanie do sprawy przyznania nagrody Mendelejewowi włączył się uznany szwedzki chemik Svante August Arrhenius, który choć nie był członkiem Komitetu Noblowskiego to cieszył się wielką estymą w środowisku naukowym. Argumentował on przeciwko przyznaniu nagrody Mendelejewowi ze względu na to, że układ okresowy jest osiągnięciem zbyt dawnym aby honorować je w roku 1906. Arrheniusem kierowała chęć odwetu za krytyczne uwagi jakie rosyjski uczony wysuwał w stosunku do jego teorii dysocjacji, a z drugiej strony kierowała nim ludzka zazdrość. W wyniku głosowania nagroda za rok 1906 przypadła Moissanowi, a powtórna nominacja dla Mendelejewa w roku 1907 została znowu skutecznie zablokowana przez Arrheniusa.
Następne uzupełnienia układu okresowego pierwiastków nastąpiły w wieku dwudziestym. W 1914 roku Henry Gwyn Jeffreys Moseley odkrył zależność pomiędzy długością fali promieniowania rentgenowskiego a liczbą atomowa pierwiastka, z którego wykonana jest anoda lampy. Tym samym nadał on znaczenie liczbie atomowej, która wcześniej była jedynie liczbą porządkową pierwiastka w układzie okresowym. Moseley rozwiązał również problem położenia kobaltu i niklu oraz telluru i jodu, które przez Mendelejewa zostały umieszczone w niewłaściwych miejscach. Dodatkowo wskazał dwa puste miejsca w układzie odpowiadające liczbom atomowym 43 i 61 czyli odpowiednio dla technetu i prometu.
Ostatnia modyfikacja układu okresowego nastąpiła w roku 1945. Amerykański chemik Glenn Theodore Seaborg po wyizolowaniu ameryku i kiuru w 1943 roku i zbadaniu ich właściwości doszedł do wniosku, że pierwiastki te powinny znaleźć się w osobnym fragmencie układu okresowego. W związku z sugestią Seaborga do układu okresowego dodano serię aktynowców lokując ją poniżej szeregu lantanowców.
Teoretyczne podstawy wyjaśniające konstrukcję układu okresowego znajdują się w zakładce Atom i cząsteczka → Mechanika falowa → Podstawy teoretyczne → Układ okresowy pierwiastków.