 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Pierwiastki i związki chemiczne
Pierwiastki i związki chemiczne
W tym miejscu omówione zostaną skrótowo właściwości pierwiastków i ich związków poszczególnych grup i bloków układu okresowego. Z oczywistych względów przegląd ten nie może rościć sobie prawa do kompletności, i jest jedynie wskazaniem na pewne ogólne zależności występujące w przypadku poszczególnych grup pierwiastków. Bardziej szczegółowe omówienie właściwości chemicznych znajduje się na stronach zlokalizowanych poniżej.
Pierwiastki s– i p–elektronowe
Atomy litowców posiadają tylko jeden elektron walencyjny, który jest stosunkowo słabo związany i z tego powodu w chemii główną rolę odgrywają ich kationy. Istotne znaczenie ma wzrost promienia jonowego w miarę wzrostu liczby atomowej pierwiastków tej grupy. Lit spala się na powietrzu tworząc Li2O, sód tworzy Na2O2, a potas KO2.
Kationy litowców są typowymi twardymi kwasami Lewisa i wykazują zdolność do tworzenia związków koordynacyjnych z donorami tlenowymi. Ponieważ orbital s litu posiada największą ujemną energię i dodatkowo wykazuje najsłabsze efekty odpychania przez rdzeń, tworzy najsilniejsze połączenia z donorowymi atomami tlenu. W roztworze wodnym ciepło hydratacji litu jest większe niż ciepła hydratacji innych pierwiastków tej grupy. Bardziej kowalencyjny charakter litu niż pozostałych pierwiastków grupy I wynika również z faktu posiadania najsilniej związanego orbitalu walencyjnego i małego rdzenia atomowego. To powoduje, że wykazuje on tendencję do znacznego nakrywania orbitalu 2s z orbitalami ligandów, a tym samym i wzrost kowalencyjności wiązania. W większości związków litu wiązania mają charakter spolaryzowanych wiązań jonowych. Pierwiastki grupy I tworzą związki metaloorganiczne, przy czym związki litu charakteryzują się strukturami cząsteczkowymi, a pozostałych pierwiastków tej grupy mają prawdopodobnie charakter jonowy.
Związki dwóch pierwszych pierwiastków grupy drugiej, czyli berylu i magnezu, wykazują w znacznym stopniu charakter kowalencyjny. Ponieważ obydwa pierwiastki posiadają łatwo dostępne, ze względów energetycznych, puste orbitale p to w reakcjach zachowują się jak kwasy Lewisa. Wodorki i połączenia alkilowe berylu mają struktury związków z niedoborem elektronów, w których wodór lub grypa metylowa tworzą mostki. Pozostałe pierwiastki grupy berylowców wykazują słaby charakter kwasów Lewisa lub nie wykazują go wcale. Z powodu większych rozmiarów atomów charakteryzują się małymi co do wartości energiami solwatacji i często krystalizują jako sole bezwodne. Ich fosforany(V), siarczany(VI) i siarczki są nierozpuszczalne. Pomimo znacznej wartości sumy dwóch pierwszych potencjałów jonizacji atomów tych pierwiastków, to równowaga reakcji w stanie stałym:
2MX(s) → M(s) + MX2
jest w znacznym stopniu przesunięta w prawo. Związki tych pierwiastków mają charakter jonowy. Ze względu na znaczny promień jonowy bar, jako jedyny z tej grupy, tworzy nadtlenek o wzorze BaO2, który z w reakcji z wodą ulega hydrolizie z wytworzeniem nadtlenku wodoru. W przypadku wapnia, strontu, baru i radu odkryto nieliniowe cząsteczki ich fluorków co może wskazywać na udział orbitali (n–1)d tych metali w wiązaniach.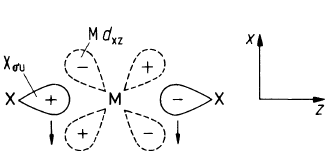 Zgięcie cząsteczki MX2 prowadzi do nakładania orbitali sigma fluorowca i dxz atomu berylowca
Zgięcie cząsteczki MX2 prowadzi do nakładania orbitali sigma fluorowca i dxz atomu berylowca
Powłoka walencyjna pierwiastków grupy trzynastej składa się z dwóch podowłok – s i p. W przypadku boru i glinu w tworzeniu wiązań uczestniczą obydwie podpowłoki, a tym samym stopień utlenienia tych pierwiastków w związkach jest równy 3. Cięższe pierwiastki tej grupy preferują stopień utlenienia 1 w związkach chemicznych. Wszystkie pierwiastki tej grupy posiadają więcej orbitali walencyjnych niż elektronów na powłoce walencyjnej. W związku z tym wszystkie one zachowują się jak kwasy Lewisa, przy czym najsilniejsze właściwości kwasowe wykazują bor i glin. Fluorek boru i chlorek glinu są silnymi kwasami Lewisa, które w przypadku braku odpowiednich zasad Lewisa tworzą połączenia dimeryczne (Al2Cl6, gdzie dwa atomy chloru pełnią rolę mostka) lub związki z niedoborem elektronów.
 Na uwagę zasługują szczególnie wysokie energie wiązań B–O i B–F. Wynika to z faktu znacznego nakładania się orbitali pπ obydwu atomów, co jest związane z małymi rozmiarami rdzeni atomowych pierwiastków drugiego okresu. Fluor i tlen łącząc się z borem dzięki płaskiej, trójkątnej geometrii tych cząsteczek, następuje znaczna donacja π na orbital 2p boru, co stabilizuje wiązania B–O i B–F.
Na uwagę zasługują szczególnie wysokie energie wiązań B–O i B–F. Wynika to z faktu znacznego nakładania się orbitali pπ obydwu atomów, co jest związane z małymi rozmiarami rdzeni atomowych pierwiastków drugiego okresu. Fluor i tlen łącząc się z borem dzięki płaskiej, trójkątnej geometrii tych cząsteczek, następuje znaczna donacja π na orbital 2p boru, co stabilizuje wiązania B–O i B–F.
Cięższe pierwiastki tej grupy, czyli gal, ind i tal, mają zapełnione podpowłoki (n–1)d, a ich właściwości chemiczne są zdeterminowane przez wiązania kowalencyjne. Tworzą one związki metaloorganiczne o budowie cząsteczkowej. Ich związki na +1 stopniu utlenienia są coraz trwalsze przy przechodzeniu w dół grupy, co jest najprawdopodobniej związane ze zmniejszeniem się udziału orbitali s w wiązaniu. Cięższe pierwiastki w coraz mniejszym stopniu wykazują charakter kwasów Lewisa, i wykazują właściwości klasy b w teorii miękkich i twardych kwasów i zasad i są często odporne na hydrolizę, jak przykładowo kation [(CH3)2Tl]+ w roztworze wodnym. Na +2 stopniu utlenienia pierwiastki te nie tworzą trwałych związków chemicznych, a związki takie jak GaCl2 są związkami o mieszanym stopniu utlenienia [Ga+(GaCl4)–]. Na +1 stopniu utlenienia charakter tych związków jest determinowany przez słabo związany elektron na orbitalu p, a przez to są one związkami jonowymi. cząsteczki fluorków, tlenków i chlorków galu, indu i talu posiadają oktaedryczne wielościany koordynacyjne, a bromki i jodki w ciele stałym tworzą dimeryczne cząsteczki poza jodkiem talu, którego cząsteczka składa się z kationu Tl+ i anionu I3–. Azotki tych pierwiastków są bardzo trwałymi związkami o strukturze wurcytu, dodatkowo azotek boru, izoelektronowy z diamentem wykazuje podobne do niego właściwości chociaż ulega hydrolizie. Glin, gal i ind tworzą z fosforem, arsenem, antymonem i bizmutem ciała stałe o właściwościach półprzewodnikowych.
Cięższe pierwiastki grupy 14 preferują +2 stopień utlenienia, na którym elektrony z orbitali s nie uczestniczą w tworzeniu wiązań. Węgiel i krzem na +2 stopniu utlenienia występują w produktach pośrednich wielu reakcji chemicznych, jednak związki te są reaktywne. Węgiel, w odróżnieniu od krzemu, tworzy wiązania podwójne i potrójne z pierwiastkami drugiego okresu, i oczywiście układy łańcuchowe C–C. Fakt ten tłumaczy się silnym nakładaniem orbitali pπ – pπ węgla i pierwiastków drugiego okresu. Natomiast silne, pojedyncze, wiązania kowalencyjne pomiędzy atomami węgla mają związek z budową elektronową atomu, w którym liczby orbitali i elektronów walencyjnych są sobie równe. W przypadku krzemu wiązanie Si–Si jest słabsze tylko o około 130 kJ/mol w porównaniu z wiązaniem C–C w diamencie, jednak wiązanie Si–H jest słabsze o ¼ od energii wiązania w cząsteczce wodoru, a dodatkowo kinetyka rozkładu wiązania krzem–wodór jest szybka.
Węgiel prawie zawsze wykazuje liczbę koordynacyjną równą 4 lub mniejszą w związkach chemicznych. Natomiast cięższe pierwiastki grupy 14, wraz z rosnącą liczbą atomową posiadają wyższe liczby koordynacyjne. Z tego względu związki tych pierwiastków na +4 stopniu utlenienia o liczbie koordynacyjnej 4 mają charakter kwasów Lewisa. Chlorek cyny(II) ma cztery orbitale walencyjne, na których znajduje się sześć elektronów, należy więc oczekiwać, że przyłączy on parę elektronową (czyli będzie zachowywał się jak kwas Lewisa). Utworzony anion postaci SnCl3– posiadający wolną parę elektronową będzie zasadą Lewisa, i rzeczywiście znane są związki typu metal–SnCl3.
 Istotną różnica pomiędzy węglem a cięższymi pierwiastkami grupy 14 jest kwasowość tetraedrycznych związków tych pierwiastków oraz różnice w sile wiązań pojedynczych Si–O, Si–F w porównaniu z mocą wiązań węgiel–tlen i węgiel–fluor. Wyjaśnienie tych zjawisk oparto na obecności pustych, wysokoenergetycznych, orbitali d pierwiastków cięższych, które mogą akceptować ładunek od zasad Lewisa, lub też z obsadzonych orbitali π ligandów. W ten sposób związki o oktaedrycznym wielościanie koordynacyjnym będą stabilizowane przez przekazanie ładunku na orbitale s, p, dx2–y2 i dz2. Tlenki i fluorki będą miały podwyższoną moc wiązania związana ze zwiększeniem rzędu wiązania wynikającego z przekazania ładunku na orbital d z obsadzonych orbitali pπ tlenu czy fluoru. Wiązania takie nazwano pπ–dπ. W przypadku cięższych chlorowców czy tlenowców nakładanie orbitali pπ jest mniejsze i efekt ten nie jest tak wyraźny.
Istotną różnica pomiędzy węglem a cięższymi pierwiastkami grupy 14 jest kwasowość tetraedrycznych związków tych pierwiastków oraz różnice w sile wiązań pojedynczych Si–O, Si–F w porównaniu z mocą wiązań węgiel–tlen i węgiel–fluor. Wyjaśnienie tych zjawisk oparto na obecności pustych, wysokoenergetycznych, orbitali d pierwiastków cięższych, które mogą akceptować ładunek od zasad Lewisa, lub też z obsadzonych orbitali π ligandów. W ten sposób związki o oktaedrycznym wielościanie koordynacyjnym będą stabilizowane przez przekazanie ładunku na orbitale s, p, dx2–y2 i dz2. Tlenki i fluorki będą miały podwyższoną moc wiązania związana ze zwiększeniem rzędu wiązania wynikającego z przekazania ładunku na orbital d z obsadzonych orbitali pπ tlenu czy fluoru. Wiązania takie nazwano pπ–dπ. W przypadku cięższych chlorowców czy tlenowców nakładanie orbitali pπ jest mniejsze i efekt ten nie jest tak wyraźny.
Chociaż dostępność orbitali d może stanowić podstawę do wyjaśnienia różnic pomiędzy węglem a pozostałymi pierwiastkami grupy 14 to jednak nie jest to aż tak oczywiste. Orbitale d mają znacznie wyższe energie niż obsadzone orbitale p, a dodatkowo ich udział energetyczny jest bardziej korzystny w przypadku pierwiastków grupy 15, gdyż większe obsadzenie orbitali p powoduje zwiększenie ekranowania orbitali d. Co więcej w związkach z bardziej elektroujemnymi pierwiastkami dodatni ładunek jonu centralnego powoduje obniżenie energii orbitali d. Z drugiej strony płaska struktura cząsteczki (SiH3)3N przemawia za udziałem orbitali d w wiązaniu krzem–azot. Analogiczny związek fosforu ma budowę piramidalną, co jest wynikiem słabego nakładania orbitalu 3pz fosforu z orbitalami d krzemu. Z drugiej strony brak jest przekonujących dowodów na to, że orbitale d wykazują w tych związkach odpowiednio duże powinowactwo elektronowe. Z tego względu oddziaływanie pπ–dπ należy traktować jako pewien model, który na dobrą sprawę nie ma uzasadnienia eksperymentalnego. W stanie stałym pierwiastki grupy 14 wykazują bardzo podobne właściwości poza ołowiem, który nie przyjmuje w stanie pierwiastkowym struktury diamentu.
Pierwiastki grupy 15, o konfiguracji powłoki walencyjnej s2p4 często występują na +3 stopniu utlenienia w związkach chemicznych, co sugeruje, że elektrony s nie uczestniczą w wiązaniach. Jednak budowa geometryczna związków azotu i fosforu wskazuje, że następuje przynajmniej częściowa hybrydyzacja orbitali s i p, gdyż kąty pomiędzy wiązaniami są większe od 90°, czyli wartości oczekiwanej dla wiązań tworzonych jedynie przy udziale orbitali p. Związki na +3 stopniu utlenienia, o piramidalnej geometrii wielościanu koordynacyjnego mają charakter zasad Lewisa (amoniak, fosfiny). Azot, jak należy się tego spodziewać, wykazuje tendencję do tworzenia wiązań podwójnych z innymi pierwiastkami drugiego okresu. Wiązania pojedyncze z pierwiastkami mającymi obsadzone orbitale pπ są słabe prawdopodobnie w wyniku odpychania elektronów w układzie pπ – pπ. Cięższe pierwiastki tej grupy tworzą związki z wiązaniami pojedynczymi o większej mocy, co jest prawdopodobnie związanie z oddziaływaniem pπ–dπ zwłaszcza dla pierwiastków trzeciego i następnych okresów, które wzmacnia wiązanie pojedyncze. Fosfor na +5 stopniu utlenienia tworzy silne, podwójne wiązania z tlenem P=O. Długość tego wiązania jest krótsza niż analogicznego wiązania azot–tlen w tlenkach amin, co w połączeniu z jego niewielką polarnością świadczy o pewnego rodzaju oddziaływaniu zwrotnym od tlenu do fosforu w układzie P=O. Fosfor tworzy z tlenów również układy łańcuchowe –P–O–P–O–. Hydroliza takich wiązań w trifosforanie adenozyny stanowi źródło energii w układach biologicznych. Wszystkie pierwiastki grupy 5 tworzą związki na +5 stopniu utlenienia, chociaż ten stopień utlenienia w przypadku azotu występuje jedynie wtedy gdy jest on połączony bezpośrednio z tlenem. Z termodynamicznego punktu widzenia azotany(V) są silnymi utleniaczami, jednak wykazują dużą trwałość kinetyczną. Podobnie związki fosforu(V) są trwałe kinetycznie. Natomiast przechodząc w dół grupy trwałość tych połączeń maleje i bizmutany(V) są silnymi utleniaczami. Wiele związków tych pierwiastków na +3 stopniu utlenienia jest silnymi reduktorami, a pięciokoordynacyjne związki cięższych pierwiastków tej grupy są silnymi kwasami Lewisa. Najsilniejszym znanym kwasem Lewisa jest SbF5. Pierwiastki od fosforu do bizmutu w połączeniach z pierwiastkami o podobnej elektroujemności tworzą układy łańcuchowe lub pierścieniowe. Fosfor i azot tworzą szereg związków o cyklicznym układzie jak w przypadku fosfazenów.
Energia orbitali p pierwiastków grupy 16, czyli tlenowców, jest już na tyle duża, że można oczekiwać występowania anionów. Jednak przyłączenie dwóch elektronów na orbitale p jest związane ze wzrostem energii odpychania i dlatego aniony są stabilizowane jedynie w sieciach jonowych. W roztworach wodnych aniony hydrolizują tworząc albo jony HX– lub cząsteczki H2X. Energia wiązania w cząsteczkach H2X, zmniejsza się przy przechodzeniu w dół grupy. Energia wiązania siarki z pierwiastkami będącymi ewentualnymi donorami π, jak halogeny, jest większa niż energia wiązania tlenu z tymi pierwiastkami. Może być to związane z oddziaływaniami typu pπ–dπ. Pierwiastki tej grupy wykazują, poza tlenem, stopnie utlenienia od –2, przez +2, +4 do +6. Tlen występuje tylko na –2 stopniu utlenienia, chociaż formalnie w związkach, w których występuje wiązanie O–O, atom tlenu może być traktowany jako posiadający inny stopień utlenienia. Trwałość związków tych pierwiastków na najwyższym, +6 stopniu utlenienia maleje wraz z przechodzeniem w dół grupy. Ponieważ na niższych stopniach utlenienia pierwiastki te posiadają wolne pary elektronowe mogą być traktowane jako zasady Lewisa. Jednak ze względu na to, że pary elektronowe są silnie związane to pierwiastki te wykazują słabe właściwości donorowe. Tlen tworzy silne wiązania kowalencyjne z mniej elektroujemnymi pierwiastkami. Natomiast z atomami chlorowców wiązania tlen–halogen są słabe, co wynika ze znacznego odpychania elektronów pπ–pπ. Mała moc wiązania tlen–tlen przejawia się w dużej reaktywności nad– oraz ponadtlenków. Cząsteczka O2 w stanie podstawowym jest paramagnetyczne, a dwa niesparowane elektrony zajmują antywiążące orbitale π*. Jon tlenkowy ma zdolność stabilizacji wysokich stopni utlenienia metali, co można tłumaczyć, na gruncie modelu jonowego, małym rozmiarem i dużym ładunkiem jonu tlenkowego, lub tez w oparciu o teorię orbitali cząsteczkowych donorowymi (σ i π) właściwościami tego jonu.
W roztworach siarka tworzy najtrwalsze związki na +6 stopniu utlenienia, a związki cięższych pierwiastków tej grupy na najwyższym możliwym stopniu utlenienia wykazują właściwości utleniające. Cięższe pierwiastki w połączeniu z pierwiastkami o podobnej elektroujemności tworzą łańcuchy lub pierścienie. Przykładowo siarka elementarna w odmianie rombowej występuje w postaci pierścieni S8, które w wyższych temperaturach przechodzą w formę cząsteczek S2. Podobnie selen tworzy ośmioczłonowe pierścieni jednak trwalsza jest odmiana zbudowana z długich łańcuchów. Z silnie elektrododatnimi pierwiastkami siarka, selen i tellur tworzą sole jonowe, które w roztworach wodnych ulegają hydrolizie.
Powłoka walencyjna fluorowców zawiera siedem elektronów, i charakteryzują się znacznymi wartościami powinowactw elektronowych. Aniony halogenkowe są zasadami Lewisa, chociaż znaczne powinowactwo jonu fluorkowego do protonu powoduje, że jest on słabą zasadą. Pierwiastki tej grupy występują w postaci cząsteczek dwuatomowych, których energie wiązań są na tyle niskie, że wszystkie pierwiastki tej grupy są reaktywne tak z termodynamicznego jak i kinetycznego punktu widzenia. Wiązanie F–F jest słabsze niż Cl–Cl, co tłumaczy się znacznym oddziaływaniem pπ–pπ w cząsteczce F2. Fluor jest najbardziej elektroujemnym pierwiastkiem, co tłumaczy się na gruncie modelu jonowego łatwością tworzenia jonu F– i jego małym promieniem co powoduje, że energia sieci ma znaczną wartość równoważącą energię jonizacji. W oparciu o teorię orbitali cząsteczkowych właściwości fluoru wynikają ze znacznych zdolności donorowych tego pierwiastka. Pozostałe fluorowce, od chloru do jodu, tworzą związki na dodatnich stopniach utlenienia, z których ważnymi są kwasy tlenowe. Na +1 stopniu utlenienia kwasy typu HOX tworzą jedynie chlor i brom, i są one termodynamicznie nietrwałe ulegając reakcji dysproporcjonowania do X– i XO3–. Aniony kwasów na +5 stopniu utlenienia są trwałe, i są silnymi utleniaczami.
Pierwiastki d–elektronowe
Zmiany właściwości chemicznych metali przejściowych są mniej wyraźne niż w przypadku pierwiastków p–elektronowych. Rozpatrując zmiany promieni jonowych pierwiastków trzeciego okresu zauważamy, że zmniejszają się one do V2+, następnie zwiększają do Mn2+, a następnie zmniejszają do Ni2+ i lekko zwiększają do Zn2+.
 Takie zmiany są bezpośrednio związane ze struktura elektronową soli tych pierwiastków. Wzrost ładunku jądra i słabe wzajemne ekranowanie orbitali 3d powoduje, że promienie jonowe zmniejszają się w miarę przesuwania się wzdłuż okresu. Gdy jednak kolejny elektron zajmuje antywiążący poziom eg* następuje wzrost odpychania elektronów, co powoduje zwiększenie promienia jonowego. Kolejne elektrony ulegające sparowaniu na poziomie t2g powodują zmniejszenie promienia jonowego. Opis wiązań i właściwości związków koordynacyjnych pierwiastków d-elektronowych znajduje się w zakładce Związki metali przejściowych i następnych.
Takie zmiany są bezpośrednio związane ze struktura elektronową soli tych pierwiastków. Wzrost ładunku jądra i słabe wzajemne ekranowanie orbitali 3d powoduje, że promienie jonowe zmniejszają się w miarę przesuwania się wzdłuż okresu. Gdy jednak kolejny elektron zajmuje antywiążący poziom eg* następuje wzrost odpychania elektronów, co powoduje zwiększenie promienia jonowego. Kolejne elektrony ulegające sparowaniu na poziomie t2g powodują zmniejszenie promienia jonowego. Opis wiązań i właściwości związków koordynacyjnych pierwiastków d-elektronowych znajduje się w zakładce Związki metali przejściowych i następnych.
Wszystkie kationy metali są kwasami Lewisa, co szczególnie zaznacza się w przypadku związków tych pierwiastków o małych liczbach koordynacyjnych. Aniony tlenkowe tych pierwiastków są trwałe w roztworach zasadowych, ale polimeryzują po zakwaszeniu, tworząc skomplikowane układy polimeryczne, w których oktaedry są połączone ze sobą atomami tlenu. Do rzadkich przypadków należy zachowanie jonów metali przejściowych jak zasad Lewisa. Spotykane jest to w przypadku związków irydu(II) o kwadratowej geometrii sfery koordynacyjnej.
Pierwiastki f-elektronowe
Lantanowce tworzą twarde kationy z klasy a według Ahrlanda. Różnice pomiędzy poszczególnymi pierwiastkami wynikają ze zmniejszania się promieni atomowych w miarę zapełniania elektronami powłoki 4f. Lantan posiada puste, nie biorące udziału w wiązaniach chemicznych orbitale 4f, a cer ściśle związany niewiążący poziom 4f. Odpychanie elektronów na podpowłoce 4f jest duże i przejawia się nieciągłością w konfiguracji stanu podstawowego gadolinu, którego powłoka walencyjna ma konfigurację 4f 75d 16s 2.
Typowym stopniem utlenienia lantanowców jest +3, ponieważ utrata jednego z elektronów z powłoki f powoduje na tyle duży wzrost energii sieci krystalicznej, że jonu na +2 stopniu utlenienia mają silnie redukujące właściwości. Bardzo małe wartości energii rozszczepienia w polu ligandów świadczą o niewiążącym charakterze orbitali 4f. Jony lantanowców maja duże rozmiary i pomimo znacznego ładunku (formalnie +3) nie wywierają silnego wpływu polaryzacyjnego na ligandy, zachowując się jak twarde kwasy Lewisa. Akwojony ulegają hydrolizie, a podwyższanie pH prowadzi do wytrącania uwodnionych wodorotlenków tych pierwiastków. Liczby koordynacyjne jonów lantanowców są duże, a związki o oktaedrycznym wielościanie koordynacyjnym należą do rzadkości.
Struktury elektronowe jonów aktynowców są skomplikowane. W stanie podstawowym orbitale 5f, 6d i 7s mają zbliżone energie, a konfiguracja 5f n7s2 występuje dopiero w przypadku plutonu. Dla lżejszych pierwiastków z tego szeregu podpowłoka 6d jest częściowo obsadzona elektronami. Generalnie orbitale 5f są mocniej związane niż ma to miejsce w przypadku orbitali 4f lantanowców, jednocześnie oddziaływanie orbitali 5f aktynowców z ligandami jest większe niż orbitali 4f lantanowców. Ze względu na budowę elektronową atomów aktynowców wykazują one większe zróżnicowanie stopni utlenienia niż lantanowce. Początkowe pierwiastki szeregu mają tendencję do tworzenia jonów na +4, +5 i +6 stopniu utlenienia czyli wykorzystywania wszystkich elektronów walencyjnych. Przykładowo jon Th3+ jest nietrwały, a związki toru, protaktynu i uranu są trwałe na wyższych stopniach utlenienia. Znane sa związki neptunu(VII) i plutonu(VII), ale już ameryk tworzy najtrwalsze związki chemiczne na +3 stopniu utlenienia. Ameryk i dalsze pierwiastki szeregu aktynowców tworzą trwałe związki na +2 stopniu utlenienia, gdyż konfiguracja takiego jonu – 5f 7 – jest energetycznie korzystna. Generalnie aktynowce tworzą trwałe związki na stopniach utlenienia do +6 do uranu, i +3 od ameryku do nobla. Elektrony na orbitalach 5f w przypadku neptunu, plutonu i ameryku są niewiążące, ale w jonie UO22+ nie ma elektronów niewiążących. Związki aktynowców w roztworach wodnych ulegają całkowitej hydrolizie o odczynie kwaśnym.