 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Powłoka walencyjna atomów pierwiastków przejściowych
Powłoka walencyjna atomów pierwiastków przejściowych
Rozpatrzenie, które elektrony należą do powłoki walencyjnej jonów centralnych związków koordynacyjnych nie jest wbrew pozorom tak oczywiste jak mogłoby się wydawać. Jest to jeden z powodów zawodzenia teorii wiązań walencyjnych przy wyjaśnianiu budowy i właściwości tych związków. Rozpatrywanie powłok walencyjnych rozpoczniemy od zdefiniowania dwóch rodzajów związków koordynacyjnych. Pierwszy rodzaj tak zwane związki typu Wernera to związki koordynacyjne, w których występują wyłącznie wiązania typu σ pomiędzy ligandem i jonem centralnym. Związki koordynacyjne, w których występują wiązania π oraz wiązania zwrotne (redonorowe) są drugim rodzajem związków koordynacyjnych. Dla związków pierwszego rodzaju radialne części funkcji falowych dla orbitali 3d, 4s i 4p przedstawione zostały na rysunku.
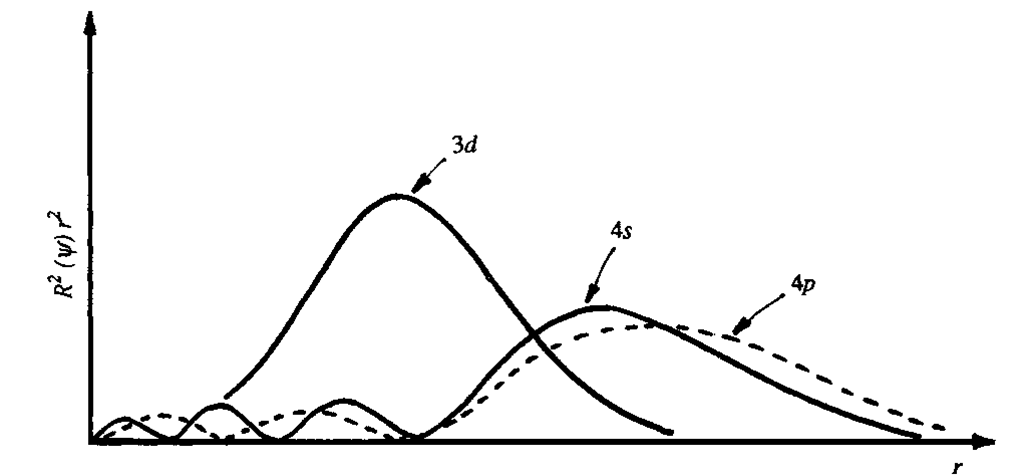 Radialne części funkcji falowych dla orbitali 3d, 4s i 4p.Jak widać orbital 3d jest w znacznym stopniu „ukryty” w zrębie atomowym jonu centralnego, a co za tym idzie jego nakładanie z orbitalami ligandów powinno być stosunkowo małe. Aby jednak móc oszacować to oddziaływanie rozpatrzmy energię orbitali ligandów i orbitali powłoki walencyjnej atomu centralnego. Dla jonów centralnych o wysokich stopniach utlenienia szereg orbitali ligandów i atomu centralnego względem wzrastającej energii jest następujący: σ-donorowe orbitale ligandów < metal 3d <metal 4s < metal 4p. W związku z tym powinniśmy oczekiwać dużego oddziaływania orbitali ligandów z orbitalami 3d atomu centralnego ze względu na równoważność udziału energetycznego orbitalu atomu centralnego w wiązaniu koordynacyjnym z udziałem gęstości elektronowej tego orbitalu w wiązaniu. Jednak jeśli weźmiemy pod uwagę wielkości nakładania się orbitali ligandów i atomu centralnego otrzymamy następujący szereg 4p ≥ 4s > 3d co zostało zobrazowane na poniższym rysunku.
Radialne części funkcji falowych dla orbitali 3d, 4s i 4p.Jak widać orbital 3d jest w znacznym stopniu „ukryty” w zrębie atomowym jonu centralnego, a co za tym idzie jego nakładanie z orbitalami ligandów powinno być stosunkowo małe. Aby jednak móc oszacować to oddziaływanie rozpatrzmy energię orbitali ligandów i orbitali powłoki walencyjnej atomu centralnego. Dla jonów centralnych o wysokich stopniach utlenienia szereg orbitali ligandów i atomu centralnego względem wzrastającej energii jest następujący: σ-donorowe orbitale ligandów < metal 3d <metal 4s < metal 4p. W związku z tym powinniśmy oczekiwać dużego oddziaływania orbitali ligandów z orbitalami 3d atomu centralnego ze względu na równoważność udziału energetycznego orbitalu atomu centralnego w wiązaniu koordynacyjnym z udziałem gęstości elektronowej tego orbitalu w wiązaniu. Jednak jeśli weźmiemy pod uwagę wielkości nakładania się orbitali ligandów i atomu centralnego otrzymamy następujący szereg 4p ≥ 4s > 3d co zostało zobrazowane na poniższym rysunku.
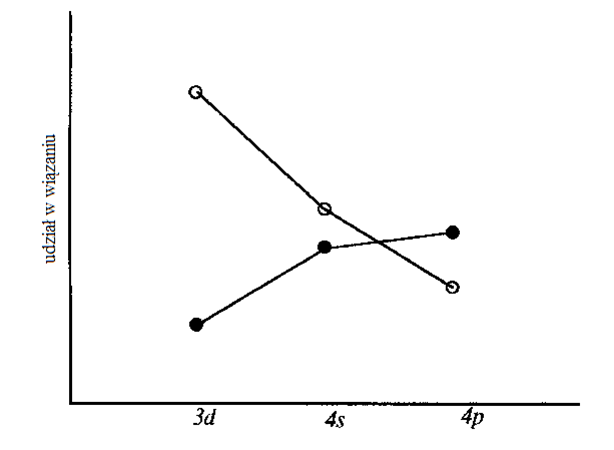 Udział orbitali atomu centralnego pod względem energii (○) i wzajemnego nakładania (●) w wiązaniach w związkach koordynacyjnych metali na wysokich stopniach utlenienia.Takie podejście do oddziaływania ligandów z atomem centralnym w związku koordynacyjnym faworyzuje oddziaływanie orbitalu 4s z orbitalami ligandów przy tworzeniu wiązań metal-ligand. Orbital typu s jest sferyczny, czyli wpływ na geometrię kompleksu mają jedynie oddziaływania wzajemne ligandów. W ten sposób geometrię związków koordynacyjnych rozpatruje się w oparciu o koncepcję VSEPR, a dokładniej o model Keperta. W modelu tym struktura elektronowa atomu centralnego nie ma wpływu na geometrię związku koordynacyjnego, która jest uzależniona od wzajemnego oddziaływania ligandów. Mimo prostoty takiego podejścia budowa geometryczna znacznej liczby związków koordynacyjnych może być wyjaśniona przy zastosowaniu tego modelu.
Udział orbitali atomu centralnego pod względem energii (○) i wzajemnego nakładania (●) w wiązaniach w związkach koordynacyjnych metali na wysokich stopniach utlenienia.Takie podejście do oddziaływania ligandów z atomem centralnym w związku koordynacyjnym faworyzuje oddziaływanie orbitalu 4s z orbitalami ligandów przy tworzeniu wiązań metal-ligand. Orbital typu s jest sferyczny, czyli wpływ na geometrię kompleksu mają jedynie oddziaływania wzajemne ligandów. W ten sposób geometrię związków koordynacyjnych rozpatruje się w oparciu o koncepcję VSEPR, a dokładniej o model Keperta. W modelu tym struktura elektronowa atomu centralnego nie ma wpływu na geometrię związku koordynacyjnego, która jest uzależniona od wzajemnego oddziaływania ligandów. Mimo prostoty takiego podejścia budowa geometryczna znacznej liczby związków koordynacyjnych może być wyjaśniona przy zastosowaniu tego modelu.
Zaprezentowane powyżej radialne części funkcji falowych dla orbitali 3d, 4s i 4p są właściwe dla swobodnego jonu lub związku koordynacyjnego, w którym jon centralny znajduje się na wysokim stopniu utlenienia. Dla związków koordynacyjnych, w którym jony centralne są na niskich stopniach utlenienia, a ligandy wykazują właściwości π-akceptorowe (jak CO) radialne części funkcji falowych pokazano na dolnym wykresie na poniższym schemacie.
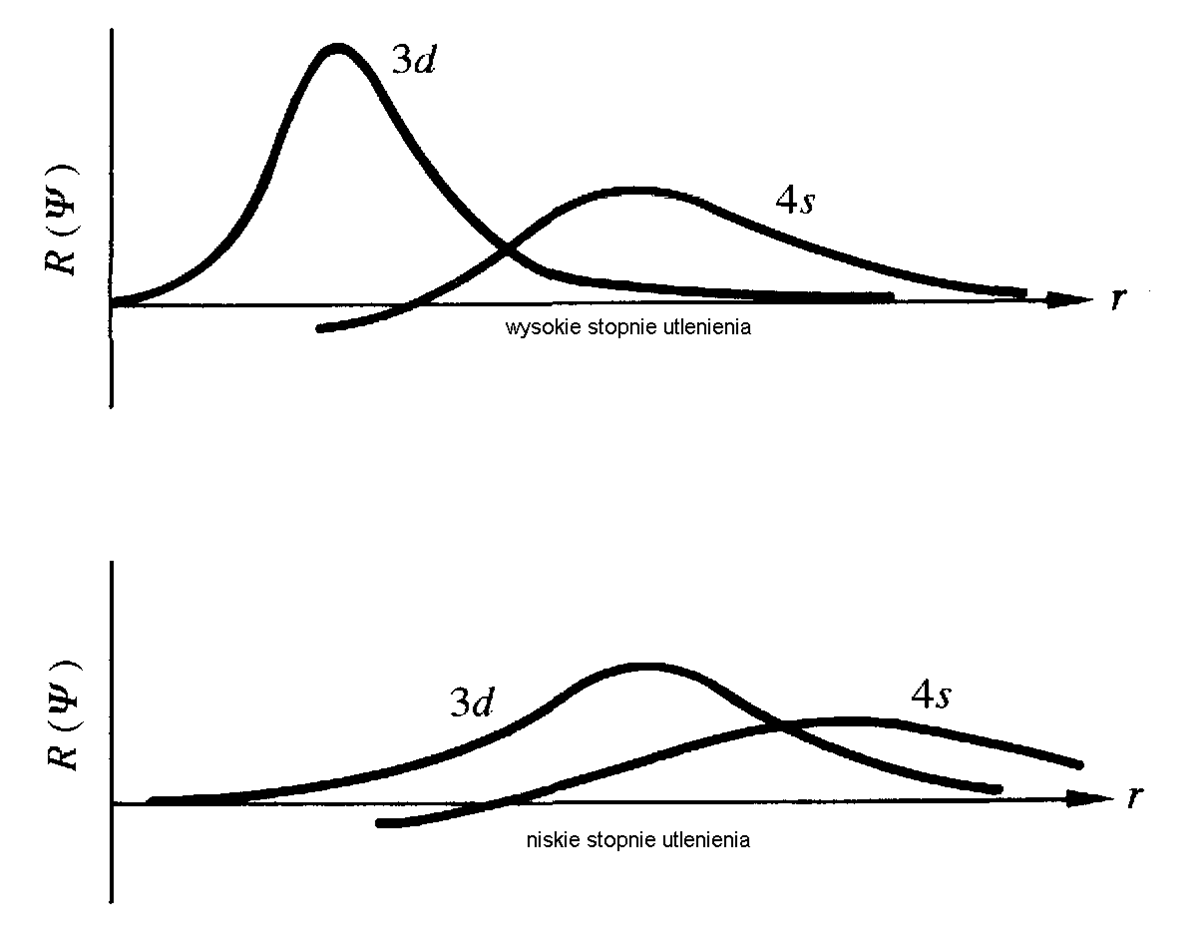 Radialne części funkcji falowych dla orbitali 3d i 4s dla wysokich i niskich stopniu utleniania jonów centralnych.Jak widać dla jonów centralnych o niskich stopniach utlenienia orbitale 3d nie są już ekranowane poprzez zrąb atomowy, a praktycznie ich udział w tworzeniu wiązań z orbitalami ligandów jest taki jak orbitali 4s i 4p. O ile dla związków koordynacyjnych metali o wysokich stopniach utlenienia (klasyczne związki koordynacyjne) obecność niesparowanych elektronów nie wpływa na ich trwałość, o tyle związki koordynacyjne jonów metali d-elektronowych na niskich stopniach utlenienia są z reguły diamagnetyczne. Dla tych układów reguła 18-elektronów jest dość ściśle spełniona. Kolejnym aspektem, na który należy zwrócić uwagę jest różnica w wiązaniach z jakimi mamy do czynienia w związkach koordynacyjnych metali o wysokich i niskich stopniach utleniania. Można oczekiwać, że wskazane powyżej różnice są uzależnione od ligandów, a dokładniej od ich właściwości donorowo-akceptorowych czyli rozkładu gęstości elektronowej i zmiany radialnych części funkcji falowych orbitali walencyjnych w związkach koordynacyjnych w odniesieniu do swobodnych jonów. Jednak efekt nefeloauksetyczny dla obydwu układów (wysoki lub niski stopień utlenienia) jest podobny, gdyż dostarczenie ładunku ze strony liganda odbywa się na orbitale typu 4s lub 4p, które charakteryzują się większą zdolnością „penetracji” powłoki walencyjnej. Na kolejnym rysunku zaznaczono efekt nefeloauksetyczny dla związków metali 3d-elektronowych o wysokich i niskich stopniach utlenienia, i jak widać to zmiana stopnia utlenienia ma znaczący wpływ na wartość radialnych części funkcji falowych orbitali 3d, a nie ligandy, których oddziaływanie obrazuje efekt nefeloauksetyczny.
Radialne części funkcji falowych dla orbitali 3d i 4s dla wysokich i niskich stopniu utleniania jonów centralnych.Jak widać dla jonów centralnych o niskich stopniach utlenienia orbitale 3d nie są już ekranowane poprzez zrąb atomowy, a praktycznie ich udział w tworzeniu wiązań z orbitalami ligandów jest taki jak orbitali 4s i 4p. O ile dla związków koordynacyjnych metali o wysokich stopniach utlenienia (klasyczne związki koordynacyjne) obecność niesparowanych elektronów nie wpływa na ich trwałość, o tyle związki koordynacyjne jonów metali d-elektronowych na niskich stopniach utlenienia są z reguły diamagnetyczne. Dla tych układów reguła 18-elektronów jest dość ściśle spełniona. Kolejnym aspektem, na który należy zwrócić uwagę jest różnica w wiązaniach z jakimi mamy do czynienia w związkach koordynacyjnych metali o wysokich i niskich stopniach utleniania. Można oczekiwać, że wskazane powyżej różnice są uzależnione od ligandów, a dokładniej od ich właściwości donorowo-akceptorowych czyli rozkładu gęstości elektronowej i zmiany radialnych części funkcji falowych orbitali walencyjnych w związkach koordynacyjnych w odniesieniu do swobodnych jonów. Jednak efekt nefeloauksetyczny dla obydwu układów (wysoki lub niski stopień utlenienia) jest podobny, gdyż dostarczenie ładunku ze strony liganda odbywa się na orbitale typu 4s lub 4p, które charakteryzują się większą zdolnością „penetracji” powłoki walencyjnej. Na kolejnym rysunku zaznaczono efekt nefeloauksetyczny dla związków metali 3d-elektronowych o wysokich i niskich stopniach utlenienia, i jak widać to zmiana stopnia utlenienia ma znaczący wpływ na wartość radialnych części funkcji falowych orbitali 3d, a nie ligandy, których oddziaływanie obrazuje efekt nefeloauksetyczny.
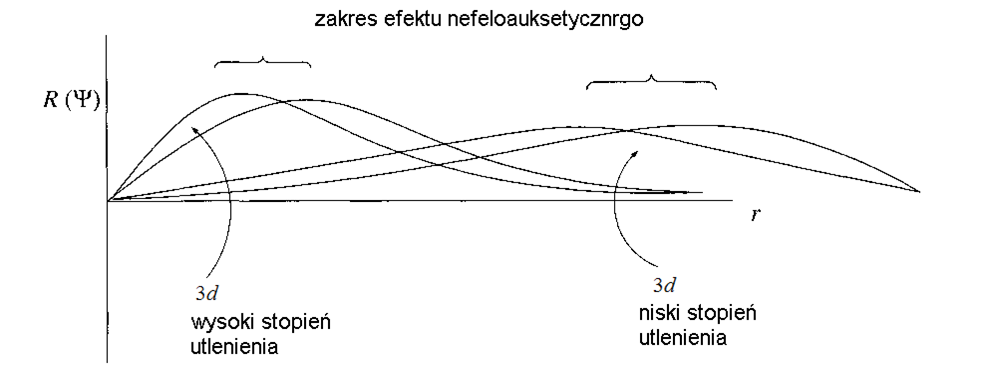 Nefeloauksetyczne poszerzenie radialnych części funkcji falowych orbitali 3d w odniesieniu dla różnych stopni utlenienia atomu centralnego.Pozostają do rozważenia elektrony podpowłoki f. Tak lantanowce jak i aktynowce oczywiście zawierają częściowo zapełnione te podpowłoki i można oczekiwać, że elektrony te będą uczestniczyć w tworzeniu wiązań chemicznych. Uważa się, że orbitale 4f lantanowców są na tyle małe, że ich nakładanie się z orbitalami ligandów jest znikome. W przypadku aktynowców sytuację komplikuje fakt, że poziomy energetyczne orbitali 4f, 6d, 7s i 7p są bardzo zbliżone. Rejestrowane absorpcyjne widma elektronowe związków metali f-elektronowych wykazują intensywne pasma przejść f→d i bardzo mało intensywne i wąskie pasma przejść f→f. Dodatkowo pasma tych przejść niemal zupełnie nie podlegają wpływom otoczenia chemicznego, czyli zmiana ligandów ma znikomy wpływ na ich położenie i intensywność. Wartość parametru nefeloauksetycznego dla lantanowców jest od 2,5 do 10 razy mniejsza w porównaniu do wartości dla jonów metali 3d-elektronowych. Orbitale 5f aktynowców w większym stopniu niż 4f lantanowców uczestniczą w wiązaniach chemicznych. Dla aktynowców pasma absorpcyjne na widmach elektronowych są szersze i znacznie intensywniejsze niż w przypadku lantanowców.
Nefeloauksetyczne poszerzenie radialnych części funkcji falowych orbitali 3d w odniesieniu dla różnych stopni utlenienia atomu centralnego.Pozostają do rozważenia elektrony podpowłoki f. Tak lantanowce jak i aktynowce oczywiście zawierają częściowo zapełnione te podpowłoki i można oczekiwać, że elektrony te będą uczestniczyć w tworzeniu wiązań chemicznych. Uważa się, że orbitale 4f lantanowców są na tyle małe, że ich nakładanie się z orbitalami ligandów jest znikome. W przypadku aktynowców sytuację komplikuje fakt, że poziomy energetyczne orbitali 4f, 6d, 7s i 7p są bardzo zbliżone. Rejestrowane absorpcyjne widma elektronowe związków metali f-elektronowych wykazują intensywne pasma przejść f→d i bardzo mało intensywne i wąskie pasma przejść f→f. Dodatkowo pasma tych przejść niemal zupełnie nie podlegają wpływom otoczenia chemicznego, czyli zmiana ligandów ma znikomy wpływ na ich położenie i intensywność. Wartość parametru nefeloauksetycznego dla lantanowców jest od 2,5 do 10 razy mniejsza w porównaniu do wartości dla jonów metali 3d-elektronowych. Orbitale 5f aktynowców w większym stopniu niż 4f lantanowców uczestniczą w wiązaniach chemicznych. Dla aktynowców pasma absorpcyjne na widmach elektronowych są szersze i znacznie intensywniejsze niż w przypadku lantanowców.
Samo oszacowanie efektu nefeloauksetycznego w przypadku związków koordynacyjnych nie jest trudne. Analizując absorpcyjne widma elektronowe związku koordynacyjnego możemy wyznaczyć wartość parametru rozczepienia 10Dq oraz wyliczyć wartość parametru B Racah. Jak ustalono wartość tego parametru dla związku koordynacyjnego jest zawsze mniejsza niż dla izolowanego jonu centralnego. Innymi słowy zmniejszenie odpychania pomiędzy elektronami w związku wywołuje efekt rozprzestrzeniania się gęstości elektronowej. Jest tutaj pewna niekonsekwencja, na którą należy zwrócić uwagę. Otóż parametr Racah zastosowany do omawiania odpychania elektronowego został wprowadzony w oparciu o sferyczną symetrię pola krystalicznego, a tymczasem w związku koordynacyjnym symetria ta jest niższa. Takie podejście zakłada uśrednienie efektów odpychania elektronowego na orbitalach t2g i eg, które zachowują się odmiennie przy tworzeniu wiązań chemicznych w związku koordynacyjnym. Jednak z analizy widm elektronowych związków koordynacyjnych praktycznie nigdy nie mamy możliwości obliczenia wszystkich parametrów charakteryzujących odpychanie elektronowe ze względu na brak dostatecznej ilości pasm absorpcyjnych. Jednak wyznaczenie parametru B i znajomość jego wartości dla jonu swobodnego B0 pozwala wyznaczyć wartość β=B/B0 czyli parametr nefeloauksetyczny. Efekt nefeloauksetyczny, podobnie jak parametr rozszczepienia, da się rozłożyć na czynniki związane z ligandem i atomem centralnym:
(1– β)=k(liganda)·h(atomu centralnego)
i podobnie jak w przypadku szeregu spektrochemicznego można ułożyć szereg nefeloauksetyczny ligandów.
F– < H2O < NH3 < en < O2– < NCS– < Cl– < CN– < Br– < I–
Szereg wiąże się ze zmniejszeniem elektroujemności i wzrostem właściwości redukujących, jak również z większym nakładaniem się orbitali ligandów z orbitalami metalu. Szereg nefeloauksetyczny ligandów różni się od szeregu spektrochemicznego. W przypadku atomów centralnych obydwa szeregi są zbliżone, przy czym efekt nefeloauksetyczny nie wykazuje znaczących zmian przy przejściu od metali 3d do 5d, ale wzrasta ze wzrostem stopnia utlenienia atomu centralnego.
Efekt nefeloauksetyczny związany jest z dwoma zjawiskami występującymi w związku koordynacyjnym. Pierwsze może być wyjaśniony przez teorię pola krystalicznego, a drugi o kowalencyjność. Pierwsze związane jest z przeniesieniem ładunku ujemnego z ligandów na atom centralny jak i z ujemnym potencjałem ligandów zmniejszającym efektywny ładunek atomu centralnego. Mniejszy ładunek efektywny atomu centralnego powoduje zmniejszenie przyciągania elektronów d i w konsekwencji osłabienie odpychania między nimi (mogą zająć większą przestrzeń). Kowalencyjność natomiast jest ograniczona symetrią związku koordynacyjnego i ma związek z utworzeniem orbitali cząsteczkowych, z orbitali d, (poziomu t2g i eg) i rozszerzeniem się tych orbitali na ligandy, co znowu w konsekwencji prowadzi do osłabienia odpychania miedzy elektronami. Ponieważ orbitale składowe poziomów t2g i eg tworzą orbitale cząsteczkowe w różny sposób, należy oczekiwać różnych efektów nefeloauksetycznych dla tych poziomów. Te różne efekty nefeloauksetyczne znalazły odzwierciedlenie w różnych wartościach parametru nefeloauksetycznego. Otóż średni parametr nefeloauksetyczny oznaczany jest jako b35, a efekty związane z elektronami na poziomach t2g i eg odpowiednio β55 i β33. Wartość parametru β pozwala z definicji na oszacowanie efektu przeniesienia elektronów jonu centralnego na akceptorowe orbitale ligandów. Wraz ze wzrostem kowalencyjności wiązania maleje wartość parametru β. Jak wspomniano powyżej wyznaczenie parametru nefeloauksetycznego jest możliwe na podstawie analizy przejść elektronowych widocznych na widmach UV-Vis związków koordynacyjnych. Istnieje jeszcze jedna możliwość. W związku koordynacyjnym poza oddziaływaniem elektronów d metalu z elektronami ligandów prowadzącym do zmiany degeneracji orbitali nd atomu centralnego oraz oddziaływaniem wzajemnym elektronów jonu centralnego różnicującym energie termów odpowiadającą danej konfiguracji elektronowej (dn), występuje również sprzężenie spinowo-orbitalne. Sprzężenie Russela-Sandersa odpowiada za dalsze zmniejszanie zwyrodnienia termów. Podobnie jak w przypadku obniżenia wartości parametrów B i C Racah jonu swobodnego przy tworzeniu związku koordynacyjnego, tak też zmianie ulega stała oddziaływania spinowo-orbitalnego. Wartość tej stałej dla jonu metalu skoordynowanego przez ligandy jest niższa niż w przypadku swobodnego jonu. W związku z tym znając wartości stałych sprzężenia dla związku koordynacyjnego i swobodnego jonu możemy wyznaczyć średnią wartość parametru β35, lub też wyznaczając wartość parametru nefeloauksetycznego możemy oszacować wartość sprzężenia spinowo-orbitalnego dla danego jonu centralnego w związku koordynacyjnym. Wartości parametrów B i C dla swobodnych jonów izolowanych zostały wyznaczone, a niektóre z nich zebrano w tabeli łącznie z wartościami sprzężenia spinowo-orbitalnego.
|
Mn+ |
|
Ti |
Zr |
Hf |
V |
Nb |
Ta |
Cr |
Mo |
W |
Mn |
Tc |
Re |
Fe |
Ru |
Os |
Co |
Rh |
Ir |
Ni |
Pd |
Pt |
Cu |
Ag |
Au |
|
|
B |
560 |
250 |
280 |
580 |
300 |
350 |
790 |
455 |
370 |
720 |
|
850 |
805 |
|
|
800 |
600 |
|
1025 |
|
|
|
|
|
|
0 |
C |
1840 |
1980 |
|
2270 |
2390 |
1290 |
2520 |
1770 |
1900 |
3090 |
|
1190 |
3510 |
|
|
4170 |
3240 |
|
4230 |
|
|
|
|
|
|
|
ξ |
110 |
335 |
1310 |
160 |
475 |
1660 |
220 |
550 |
2090 |
240 |
650 |
2290 |
390 |
880 |
|
520 |
970 |
|
600 |
1410 |
4050 |
820 |
|
4900 |
|
|
B |
680 |
450 |
440 |
660 |
260 |
480 |
710 |
440 |
|
870 |
|
|
870 |
470 |
|
880 |
670 |
|
1040 |
|
|
1220 |
|
|
|
1+ |
C |
2480 |
1770 |
1530 |
2420 |
1990 |
1840 |
2790 |
1990 |
|
3130 |
|
|
3640 |
1810 |
|
3830 |
2310 |
|
|
|
|
4750 |
|
|
|
|
ξ |
88 |
340 |
|
136 |
490 |
|
222 |
670 |
|
254 |
660 |
|
356 |
890 |
|
456 |
1210 |
|
603 |
1320 |
3370 |
828 |
1830 |
5090 |
|
|
B |
720 |
540 |
|
770 |
530 |
|
830 |
|
|
960 |
|
|
1060 |
|
|
1120 |
620 |
|
1080 |
830 |
600 |
1240 |
|
|
|
2+ |
C |
2630 |
1640 |
|
2860 |
2100 |
|
3430 |
|
|
3330 |
|
|
3900 |
|
|
4370 |
4000 |
|
4830 |
2620 |
|
4660 |
|
|
|
|
ξ |
121 |
|
|
170 |
|
|
230 |
|
|
300 |
|
|
400 |
|
|
515 |
|
|
630 |
|
|
830 |
1849 |
|
|
|
B |
|
|
|
860 |
600 |
|
1030 |
610 |
|
1140 |
|
|
|
|
|
1100 |
720 |
660 |
|
|
|
|
|
|
|
3+ |
C |
|
|
|
4170 |
1370 |
|
3850 |
|
|
3680 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ξ |
155 |
500 |
|
210 |
670 |
|
275 |
820 |
|
355 |
|
|
460 |
|
|
580 |
|
|
715 |
|
|
890 |
|
|